Umpolung ( немецкий: [ˈʔʊmˌpoːlʊŋ] ) или инверсия полярности в органической химии - это химическая модификация функциональной группы с целью изменения полярности этой группы. [1] [2] Эта модификация допускает вторичные реакции этой функциональной группы, которые в противном случае были бы невозможны. [3] Эта концепция была введена Д. Зеебахом (отсюда немецкое слово umpolung для обозначения обратной полярности) и Э. Дж. Кори . Анализ полярности во время ретросинтетического анализа сообщает химику, когда необходима тактика умполунга для синтеза целевой молекулы.
Введение [ править ]
Подавляющее большинство важных органических молекул содержат гетероатомы, которые поляризуют углеродные скелеты в силу своей электроотрицательности. Следовательно, в стандартных органических реакциях большинство новых связей образуется между атомами противоположной полярности. Это можно считать «нормальным» режимом реактивности.
Одним из следствий этого естественного поляризации молекул является то , что 1,3- и 1,5- замещенный гетероатом углеродных скелетов чрезвычайно легко синтезировать ( альдольную реакция , конденсация клайзена , реакция Михаэля , Клайзена перегруппировка , Дильс-Альдер ), тогда как 1, Схемы замещения 2-, 1,4- и 1,6-гетероатомов труднее получить через «нормальную» реактивность. Поэтому важно понимать и разрабатывать методы индукции умполунга в органических реакциях.
Примеры [ править ]
Самый простой способ получить схемы замещения 1,2-, 1,4- и 1,6-гетероатомов - начать с них. Биохимические и промышленные процессы могут обеспечить недорогие источники химикатов, которые обычно имеют недоступные схемы замещения. Например, в большом количестве присутствуют аминокислоты, щавелевая кислота, янтарная кислота, адипиновая кислота, винная кислота и глюкоза, которые обеспечивают нестандартные схемы замещения.
Умполунг цианидного типа [ править ]
Канонический реагент умполунга - это цианид-ион . Цианид-ион необычен тем, что углерод, трижды связанный с азотом, должен иметь (+) полярность из-за более высокой электроотрицательности атома азота. Тем не менее, отрицательный заряд цианид-иона локализован на углероде, придавая ему формальный заряд (-). Эта химическая амбивалентность приводит к умполунгу во многих реакциях с участием цианида.
Например, цианид - ключевой катализатор конденсации бензоина , классический пример инверсии полярности.
Конечным результатом бензоиновой реакции является образование связи между двумя атомами углерода, которые обычно являются электрофилами.
N-гетероциклические карбены [ править ]
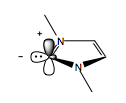
N-гетероциклические карбены или NHC подобны цианиду по реакционной способности. Как и цианид, NHC обладают необычной химической амбивалентностью, что позволяет им запускать умполунг в реакциях, в которых он участвует. Карбен имеет шесть электронов - по два в одинарных связях углерод-азот, два в его sp 2 -гибридизированной орбитали и пустую p-орбиталь. Неподеленная пара sp 2 действует как донор электронов, тогда как пустая p-орбиталь способна действовать как акцептор электронов.
В этом примере β-углерод α, β-ненасыщенного сложного эфира 1 формально действует как нуклеофил [4], тогда как обычно ожидается, что он будет акцептором Михаэля .
Этот карбен реагирует с α, β-ненасыщенным сложным эфиром 1 в β-положении, образуя промежуточный енолят 2 . Посредством таутомеризации 2b может сместить концевой атом брома на 3 . Реакция элиминирования регенерирует карбена и выпускает продукт 4 .
Для сравнения: в реакции Бейлиса-Хиллмана тот же электрофильный β-атом углерода атакуется реагентом, но в результате активируется α-положение енона как нуклеофила.
Пирофосфат тиамина [ править ]
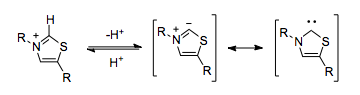
Организм человека может проявлять цианидоподобную реактивность умполунга, не полагаясь на токсичный ион цианида. Пирофосфат тиамина (который сам по себе является N-гетероциклическим карбеном ) играет идентичную функционально роль. Тиазолиевое кольцо в TPP депротонируется внутри гидрофобного ядра фермента [5], в результате чего образуется карбен, способный к умполунгу.
Ферменты, которые используют TPP в качестве кофактора, могут катализировать умполунг реакционную способность, такую как декарбоксилирование пирувата.
В отсутствие TPP декарбоксилирование пирувата привело бы к размещению отрицательного заряда на карбонильном углероде, что противоречило бы нормальной поляризации двойной связи углерод-кислород.
3-членные кольца [ править ]
В этом разделе не процитировать любые источники . ( Март 2018 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
Трехчленные кольца представляют собой напряженные фрагменты в органической химии. Когда 3-членное кольцо содержит гетероатом, такие как в эпоксиде или в бромонии промежуточной, три атом в кольце становится поляризован. Невозможно назначить (+) и (-) полярности 3-членному кольцу, не имея двух соседних атомов с одинаковой полярностью. Следовательно, всякий раз, когда поляризованное 3-членное кольцо открывается нуклеофилом, неизбежно возникает умполунг. [ необходимая цитата ] Например, открытие оксида этилена гидроксидом приводит к этиленгликолю .
Химия карбонильного полимера / анионного реле [ править ]
Химия дитиан - классический пример инверсии полярности. Это можно наблюдать в реакции Кори-Зеебаха .
Обычно атом кислорода в карбонильной группе является более электроотрицательным, чем атом углерода, и поэтому карбонильная группа реагирует как электрофил на углероде. Эта полярность может быть изменена на противоположную, когда карбонильная группа превращается в дитиан или тиоацеталь . В терминологии синтона обычная карбонильная группа представляет собой ацильный катион, а дитиан представляет собой замаскированный ацильный анион .
Когда дитиан получают из альдегида, такого как ацетальдегид, ацильный протон может отщепляться н- бутиллитием в ТГФ при низких температурах. Образованный таким образом 2-литио-1,3-дитиан реагирует как нуклеофил при нуклеофильном замещении с алкилгалогенидами, такими как бензилбромид , с другими карбонильными соединениями, такими как циклогексанон, или оксиранами, такими как фенилэпоксиэтан, как показано ниже. После гидролиза дитиановой группы конечными продуктами реакции являются α-алкилкетоны или α-гидроксикетоны . Обычным реагентом для гидролиза дитиана является(бис (трифторацетокси) иод) бензол .
Химия дитиана открывает путь ко многим новым химическим превращениям. Один пример можно найти в так называемой химии анионного реле, в которой отрицательный заряд анионной функциональной группы, возникающий в результате одной органической реакции, переносится в другое место в пределах того же углеродного каркаса и доступен для вторичной реакции. [6] В этом примере многокомпонентной реакции и формальдегид ( 1 ), и изопропилальдегид ( 8 ) превращаются в дитианы 3 и 9 с помощью 1,3-пропандитиола . Сульфид 3 сначала силилируется реакцией с трет- бутиллитием.затем удаляют триметилсилилхлорид 4 и второй ацильный протон и вводят в реакцию с оптически активным (-) - эпихлоргидрином 6, заменяя хлор. Это соединение служит субстратом для реакции с другим дитианом 9 с образованием продукта 10 раскрытия оксиранового цикла . Под влиянием полярной базы ГМФА , 10 перестраивается в перегруппировке 1,4-Брук к силилового эфира 11 реактивации дитиан группу формальдегида в качестве аниона (отсюда понятие реле анион). Эта дитиановая группа реагирует с оксираном 12 до спирта 13, и на последней стадии сульфидные группы удаляют (бис (трифторацетокси) иод) бензолом .
Тактика химии анионного реле была элегантно применена в полном синтезе сложных молекул со значительной биологической активностью, таких как спонгистатин 2 [7] и манделалид A. [8] [9]
Образование окислительной связи [ править ]
Можно образовать связь между двумя атомами углерода (-) полярности, используя окислитель, такой как йод . В этом общем синтезе энтеролактона , [10] 1,4- отношения заместителей кислорода собирает путем окислительного homocoupling карбоксилатный енолята с использованием йода в качестве окислителя.
Амин умполунг [ править ]
Обычно атом азота в аминогруппе реагирует как нуклеофил через свою неподеленную пару . Эта полярность может быть обратной, когда первичный или вторичный амин замещен хорошей уходящей группой (такой как атом галогена или алкоксигруппа ). Полученное N-замещенное соединение может вести себя как электрофил по атому азота и реагировать с нуклеофилом, как, например, при электрофильном аминировании карбанионов . [11]
Ссылки [ править ]
- ^ Seebach, D. (1979). «Методы определения реактивности». Angewandte Chemie International Edition на английском языке . 18 (4): 239–258. DOI : 10.1002 / anie.197902393 .
- ^ Gröbel, BT; Зеебах, Д. (1977). «Определение реакционной способности карбонильных соединений через серосодержащие реагенты». Синтез . 1977 (6): 357. DOI : 10,1055 / с-1977-24412 .
- ^ Seebach, D .; Кори, EJ (1975). «Получение и синтетическое применение 2-литио-1,3-дитианов». Журнал органической химии . 40 (2): 231. DOI : 10.1021 / jo00890a018 .
- ^ Fischer, C .; Смит, SW; Пауэлл, округ Колумбия; Фу, GC (2006). "Umpolung акцепторов Майкла, катализируемых N-гетероциклическими карбенами" . Журнал Американского химического общества . 128 (5): 1472–1473. DOI : 10.1021 / ja058222q . PMC 2553003 . PMID 16448117 .
- ^ Вашабау, штат Массачусетс; Дженкс, WP (1988). «Обмен тиазолия C (2) -протона: корреляции структура-реакционная способность и pKa тиамина C (2) -H повторно». Биохимия . 27 (14): 5044–5053. DOI : 10.1021 / bi00414a015 . PMID 2844248 .
- Перейти ↑ Smith AB, III, Xian M. (2006). «Химия анионных реле: эффективная тактика для синтеза, ориентированного на разнообразие». Журнал Американского химического общества . 128 (1): 66–67. DOI : 10.1021 / ja057059w . PMID 16390124 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Смит А. Б., III., Лин В., Даути В. А., Чжуан Л., McBriar MD, Кернс Ю.К., Брук CS, Муразе Н., Накаяма К. (2001). «Спонгистатины: архитектурно сложные натуральные продукты - Часть вторая: синтез субъединицы C (29–51), сборка фрагментов и окончательная разработка (+) - Спонгистатин 2». Angewandte Chemie International Edition . 40 (1): 196–199. DOI : 10.1002 / 1521-3773 (20010105) 40: 1 <196 :: АИД-ANIE196> 3.0.CO; 2-Т . PMID 11169711 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Нгуен М.Х., Иманиши М., Куроги Т., Смит А.Б., III. (2016). «Полный синтез (-) - манделалида A с использованием химии анионного реле (ARC): идентификация протокола перекрестного связывания ARC / CuCN типа II» . Журнал Американского химического общества . 138 (11): 3675–3678. DOI : 10.1021 / jacs.6b01731 . PMC 4819492 . PMID 26954306 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Нгуен МН, Иманиши М., Kurogi Т., Ван, Х., Ишмаэль J., Макфейл, К., Смит Б., III. (2018). «Синтетический доступ к семейству макролидов манделалида: разработка стратегии химии анионных реле» . Журнал органической химии . 83 (8): 4287–4306. DOI : 10.1021 / acs.joc.8b00268 . PMC 5910188 . PMID 29480727 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Belletire, JL; Фремонт, SL (1986). «Окислительная муфта». Буквы тетраэдра . 27 (2): 127. DOI : 10.1016 / S0040-4039 (00) 83958-1 .
- ^ Erdik, E .; Ай, М. (1989). «Электрофильное аминирование карбанионов». Химические обзоры . 89 (8): 1947–1980. DOI : 10.1021 / cr00098a014 .
Внешние ссылки [ править ]
| В Wikiquote есть цитаты, связанные с: Umpolung |
- ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) " umpolung ". DOI : 10,1351 / goldbook.U06551