 | |
| Имена | |
|---|---|
| Название ИЮПАК Аммониотригидроборат [ необходима ссылка ] | |
| Другие названия Боразан [ необходима ссылка ] | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.170.890 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| BNH 6 | |
| Молярная масса | 30,865 г моль -1 |
| Появление | Бесцветные кристаллы |
| Плотность | 780 мг мл -1 |
| Температура плавления | 104 ° С (219 ° F, 377 К) |
| Состав | |
| I4мм, четырехугольный | |
| Тетрагональный в B и N | |
| Тетрагидраль в B и N | |
| 5.2 D | |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| Родственные соединения | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
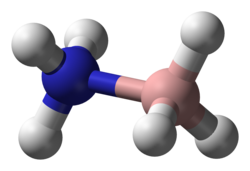
Боран аммиака (также систематически называемый амминетригидридобором ), также называемый боразаном , представляет собой химическое соединение с формулой H 3 NBH 3 . Бесцветный или твердое вещество белого цвета является наиболее простым молекулярным бором - азот - гидрид соединения. Он привлек внимание как источник водородного топлива, но в остальном представляет в первую очередь академический интерес.
Синтез [ править ]
Реакция диборана с аммиаком дает в основном диаммониатную соль [H 2 B (NH 3 ) 2 ] + (BH 4 ) - . Аммиачный боран является основным продуктом, когда аддукт борана используется вместо диборана: [1]
- BH 3 ( THF ) + NH 3 → BH 3 NH 3 + THF
Свойства и структура [ править ]
Молекула принимает структуру, подобную этану , с которой она изоэлектронна . Расстояние B-N составляет 1,58 (2) Å. Расстояния B − H и N − H составляют 1,15 и 0,96 Å соответственно. Его сходство с этаном незначительно, поскольку аммиачный боран - твердое вещество, а этан - газ: их точки плавления различаются на 284 ° C. Это различие согласуется с высокополярной природой аммиачного борана. Атомы H, присоединенные к бору, гидридные, а атомы азота, присоединенные к азоту, несколько кислые.
Структура твердого тела указывает на тесную ассоциацию центров N H и B H. Ближайшее расстояние H − H составляет 1,990 Å, что можно сравнить с расстоянием связывания H − H 0,74 Å. Это взаимодействие называется дигидрогенной связью . [2] [3] Первоначальный кристаллографический анализ этого соединения изменил назначение B и N. Обновленная структура была получена с улучшенными данными с использованием техники нейтронной дифракции, которая позволила определять местонахождение атомов водорода с большей точностью.
Использует [ редактировать ]
Аммиачный боран был предложен в качестве среды для хранения водорода , например, когда газ используется в качестве топлива для автомобилей. Это может быть сделано , чтобы выпустить водород при нагревании, полимеризоваться первым (NH 2 BH 2 ) п , затем (NHBH) п , [4] , который , в конечном счете разлагается до нитрида бора (BN) при температурах выше 1000 ° С. [5] Он более плотный по водороду, чем жидкий водород, а также способен существовать при нормальных температурах и давлениях. [6]
Боран аммиака находит применение в органическом синтезе в качестве стабильного на воздухе производного диборана. [7]
Аналогичные аминобораны [ править ]
Многие аналоги были получены из первичных, вторичных и даже третичных аминов :
- Боран трет-бутиламин ( т BuNH 2 → BH 3 )
- Боран триметиламин (Me 3 N → BH 3 )
- Боран изопропиламин ( i PrNH2 → BH 3 )
Первый аминный аддукт борана был получен из триметиламина . Боран-трет-бутиламиновый комплекс получают реакцией боргидрида натрия с трет-бутиламмонийхлоридом. Обычно аддукты более устойчивы с более основными аминами. Возможны также вариации по борному компоненту, хотя первичные и вторичные бораны встречаются реже. [8]
Кроме того, были получены многие комплексы борана, включая диметилсульфид борана (Me 2 S → BH 3 ) и боран-тетрагидрофуран (THF → BH 3 ).
Ссылки [ править ]
- ^ Шор, SG; Боддекер, KW (1964). «Крупномасштабный синтез H 2 B (NH 3 ) 2 + BH 4 - и H 3 NBH 3 ». Неорганическая химия . 3 (6): 914–915. DOI : 10.1021 / ic50016a038 .
- ^ a b Клоостер, WT; Koetzle, TF; Зигбан, PEM; Ричардсон, ТБ; Крэбтри, Р.Х. (1999). «Исследование дигидрогенной связи N − H ··· H − B, включая кристаллическую структуру BH 3 NH 3 методом нейтронной дифракции». Журнал Американского химического общества . 121 (27): 6337–6343. DOI : 10.1021 / ja9825332 .
- ^ Boese, R .; Niederprüm, N .; Блазер, Д. (1992). Максич, З.Б .; Eckert-Masic, M. (ред.). Молекулы в естествознании и медицине . Чичестер, Англия: Эллис Хорвуд. ISBN 978-0135615980.
- ^ Gutowski, M .; Отри, Т. (2006). «Особенности: Водород попадает на борт» . Мир химии . 3 (3).
- ^ Frueh, S .; Kellett, R .; Mallery, C .; Молтер; Т .; Уиллис, WS; King'ondu, C .; Суиб, SL (2011). «Пиролитическое разложение аммиачного борана до нитрида бора». Неорганическая химия . 50 (3): 783–792. DOI : 10.1021 / ic101020k . PMID 21182274 .
- ^ Стивенс, FH; Pons, V .; Бейкер, RT (2007). «Аммиак-Боран: источник водорода преимущественно ?». Сделки Дальтона . 2007 (25): 2613–2626. DOI : 10.1039 / b703053c . PMID 17576485 .
- ^ Эндрюс, Гленн С .; Neelamkavil, Santhosh F. (2008). «Боран-Аммиак». В пакете, Лео А. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк : Джон Вили и сыновья . DOI : 10.1002 / 047084289X.rb238.pub2 . ISBN 0471936235.
- ^ Staubitz, Энн; Робертсон, премьер-министр Аласдэр; Манеры, Ян (2010). «Аммиак-боран и родственные соединения как источники дигидрогена». Химические обзоры . 110 (7): 4079–4124. DOI : 10.1021 / cr100088b . PMID 20672860 .