| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Бензонитрил | |||
| Систематическое название ИЮПАК Бензолкарбонитрил | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| 3DMet | |||
| 506893 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100,002,596 | ||
| Номер ЕС |
| ||
| 2653 | |||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2224 | ||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
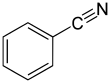
| C 6ЧАС 5(CN) | |||
| Молярная масса | 103,12 г / моль | ||
| Плотность | 1,0 г / мл | ||
| Температура плавления | -13 ° С (9 ° F, 260 К) | ||
| Точка кипения | От 188 до 191 ° C (от 370 до 376 ° F, от 461 до 464 K) | ||
| <0,5 г / 100 мл (22 ° C) | |||
| -65,19 · 10 −6 см 3 / моль | |||
Показатель преломления ( n D ) | 1,5280 | ||
| Опасности | |||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Предупреждение | ||
Формулировки опасности GHS | H302 , H312 | ||
Меры предосторожности GHS | P264 , P270 , P280 , P301 + 312 , P302 + 352 , P312 , P322 , P330 , P363 , P501 | ||
| NFPA 704 (огненный алмаз) |  2 3 0 | ||
| точка возгорания | 75 ° С (167 ° F, 348 К) | ||
самовоспламенения температуру | 550 ° С (1022 ° F, 823 К) | ||
| Пределы взрываемости | 1,4–7,2% | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Бензонитрил - это химическое соединение с формулой C
6ЧАС
5(CN) , сокращенно Ph CN. Это ароматическое органическое соединение представляет собой бесцветную жидкость со сладким запахом горького миндаля. В основном он используется в качестве предшественника бензогуанамина смолы .
Производство [ править ]
Его получают путем окислительного аммонолиза из толуола , то есть его реакция с аммиаком и кислородом (или воздухом) от 400 до 450 ° C (752 до 842 ° F). [1]
- C
6ЧАС
5CH
3+ 3/2 O
2+ NH
3→ С
6ЧАС
5(CN) + 3 H
2О
В лаборатории его можно получить дегидратацией бензамида или реакцией Розенмунда – фон Брауна с использованием цианида меди или NaCN / DMSO и бромбензола .
Приложения [ править ]
Лаборатория использует [ править ]
Бензонитрил - полезный растворитель и универсальный предшественник многих производных. Он реагирует с аминами с образованием N-замещенных бензамидов после гидролиза. [2] Это предшественник дифенилкетимина Ph.
2C = NH (точка кипения 151 ° C, 8 мм рт. Ст.) Посредством реакции с фенилмагнийбромидом с последующим метанолизом . [3]
Бензонитрил образует координационные комплексы с переходными металлами, которые растворимы в органических растворителях и легко лабильны. Одним из примеров является PdCl2(PhCN)2. Бензонитрильные лиганды легко замещаются более сильными лигандами, что делает бензонитрильные комплексы полезными синтетическими промежуточными продуктами. [4]
История [ править ]
О бензонитриле сообщил Герман Фелинг в 1844 году. Он обнаружил это соединение как продукт термической дегидратации бензоата аммония . Он вывел его структуру из уже известного аналога реакции формиата аммония с образованием формонитрила. Он также придумал название бензонитрил, которое дало название всей группе нитрилов . [5]
В 2018 году сообщалось, что бензонитрил был обнаружен в межзвездной среде . [6]
Ссылки [ править ]
- ^ Маки, Такао; Такеда, Кадзуо (июнь 2000 г.). «Бензойная кислота и производные». Энциклопедия промышленной химии Ульмана . DOI : 10.1002 / 14356007.a03_555 . ISBN 3527306730.
- ^ Купер, ФК; Куропатка, MW (1963). «N-Фенилбензамидин» . Органический синтез .; Сборник , 4 , с. 769
- ^ Пикард, PL; Толберт, Т.Л. (1973). «Дифенил кетимин» . Органический синтез .; Сборник , 5 , с. 520
- ^ Андерсон, Гордон К .; Лин, Минрен (1990). "Бис (бензонитрил) дихлорные комплексы палладия и платины". Реагенты для комплексов переходных металлов и металлоорганических синтезов . Неорганические синтезы . 28 . Джон Вили и сыновья. С. 60–63. DOI : 10.1002 / 9780470132593.ch13 . ISBN 978-0-470-13259-3.
- ^ Фелинг, Герман (1844). "Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme" (PDF) . Annalen der Chemie und Pharmacie . 49 (1): 91–97. DOI : 10.1002 / jlac.18440490106 .
- ^ Макгуайр, Бретт А .; и другие. (Январь 2018). «Обнаружение ароматической молекулы бензонитрила ( c − C
6ЧАС
5CN ) в межзвездной среде ». Science . 359 (6372): 202–205. ArXiv : 1801.04228 . Bibcode : 2018Sci ... 359..202M . Doi : 10.1126 / science.aao4890 . PMID 29326270 .
Внешние ссылки [ править ]
- Международная карта химической безопасности 1103