 | |
| Имена | |
|---|---|
| Название ИЮПАК Сульфид меди (I) | |
| Другие имена | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.040.751 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
CompTox Dashboard ( EPA ) | |
| |
| |
| Характеристики | |
| Cu 2 S | |
| Молярная масса | 159,16 г / моль |
| Плотность | 5,6 г / см 3 [1] |
| Температура плавления | 1130 ° C (2070 ° F, 1400 К) [2] |
| Нерастворимый | |
| Растворимость | мало растворим в HCl ; растворим в NH 4 OH ; растворяется в KCN ; разлагается в HNO 3 , H 2 SO 4 |
| Опасности | |
| точка возгорания | Негорючий |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 1 мг / м 3 (как Cu) [3] |
REL (рекомендуется) | TWA 1 мг / м 3 (как Cu) [3] |
IDLH (Непосредственная опасность) | TWA 100 мг / м 3 (как Cu) [3] |
| Родственные соединения | |
Другие анионы | Оксид меди (I) Селенид меди (I) |
Другие катионы | Сульфид никеля (II) Сульфид меди (II) Сульфид цинка |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Сульфид меди (I) - это сульфид меди , химическое соединение меди и серы . Он имеет химическое соединение Cu 2 S. Он встречается в природе как минерал халькоцит . Он имеет узкий диапазон стехиометрии от Cu 1.997 S до Cu 2.000 S. [4]
Подготовка и реакции [ править ]
Cu 2 S , может быть получен путем нагревания меди сильно в парах серы или H 2 S. [2] Реакция медного порошка в расплавленном серо быстро производит Cu 2 S, в то время как гранулы из меди требуют гораздо более высокой температуры. [5] Cu 2 S реагирует с кислородом с образованием SO 2 : [6]
- 2 Cu 2 S + 3 O 2 → 2 Cu 2 O + 2 SO 2
При производстве меди две трети расплавленного сульфида меди окисляются, как указано выше, и Cu 2 O реагирует с неокисленным Cu 2 S с образованием металлической Cu: [6]
- Cu 2 S + 2 Cu 2 O → 6 Cu + SO 2
Структура [ править ]
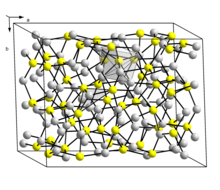
Существует две формы Cu 2 S: низкотемпературная моноклинная форма («низкохалькоцит»), которая имеет сложную структуру с 96 атомами меди в элементарной ячейке [7], и гексагональная форма, стабильная при температуре выше 104 ° C. [8] В этой структуре есть 24 кристаллографически различных атома Cu, и эта структура была описана как приближенная к гексагональному плотноупакованному массиву атомов серы с атомами Cu в плоской 3-координации. Первоначально эта структура получила ромбическую ячейку из-за двойникования кристалла образца.
Существует также кристаллографически отличная фаза (минерал джурлеит ) со стехиометрией Cu 1,96 S, которая является нестехиометрической (диапазон Cu 1,934 S-Cu 1,965 S) и имеет моноклинную структуру с 248 атомами меди и 128 атомами серы в элементарной ячейке. [7] Cu 2 S и Cu 1.96 S похожи по внешнему виду, и их трудно отличить друг от друга. [9]
См. Также [ править ]
- Сульфид меди для обзора всех фаз сульфида меди
- Моносульфид меди , CuS
- Халькоцит
- Джурлейте
Ссылки [ править ]
- ^ Patnaik, Pradyot (2002). Справочник неорганических химикатов . Макгроу-Хилл, ISBN 0-07-049439-8
- ^ a b Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Pergamon Press . п. 1373. ISBN 978-0-08-022057-4.
- ^ a b c Карманный справочник NIOSH по химической опасности. «# 0150» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Поттер, RW (1977). «Электрохимическое исследование системы медь-сера». Экономическая геология . 72 (8): 1524–1542. DOI : 10.2113 / gsecongeo.72.8.1524 .
- ^ Blachnik Р., Мюллер А. (2000). «Образование Cu 2 S из элементов I. Медь используется в виде порошков». Thermochimica Acta . 361 : 31. DOI : 10.1016 / S0040-6031 (00) 00545-1 .
- ^ a b Виберг, Эгон и Холлеман, Арнольд Фредерик (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5
- ^ а б Эванс, HT (1979). «Джурлейт (Cu 1.94 S) и низкий халькоцит (Cu 2 S): новые исследования кристаллической структуры». Наука . 203 (4378): 356–8. DOI : 10.1126 / science.203.4378.356 . PMID 17772445 .
- ^ Wells AF (1984) Структурная неорганическая химия , 5-е изд., Oxford Science Publications, ISBN 0-19-855370-6
- ^ Evans HT (1981). «Координация меди в низком халькоците и джурлеите и других богатых медью сульфидах» (PDF) . Американский минералог . 66 (7–8): 807–818.