Дипептид представляет собой органическое соединение , полученное из двух аминокислот . Составляющие аминокислоты могут быть одинаковыми или разными. Если они различны, возможны два изомера дипептида в зависимости от последовательности. Некоторые дипептиды имеют физиологическое значение, а некоторые - как физиологическое, так и коммерческое. Хорошо известным дипептидом является аспартам , искусственный подсластитель . [1]
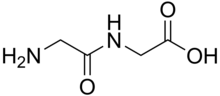
Дипептиды - белые твердые вещества. Многие из них гораздо более растворимы в воде, чем исходные аминокислоты. [1] Например, растворимость дипептида Ala-Gln составляет 586 г / л, что более чем в 10 раз превышает растворимость Gln (35 г / л). Дипептиды также могут проявлять различную стабильность, например, в отношении гидролиза. Gln не выдерживает процедур стерилизации, в отличие от этого дипептида. Поскольку дипептиды склонны к гидролизу, их высокая растворимость используется в инфузиях, т.е. для обеспечения питания. [2]
Примеры [ править ]

Коммерческая ценность [ править ]
Коммерческий интерес представляют около шести дипептидов. [1]
- Аспартам ( N - L -α-аспартил - L фенилаланина 1-метиловый эфир) представляет собой искусственный подсластитель .
- Карнозин ( бета- аланил- L- гистидин) и ансерин ( бета- аланил- N- метилгистидин ) имеют высокую концентрацию в мышцах и тканях мозга . Они используются в спортивных лекарствах.
- Ацетилкарнозин , профилактика катаракты
- Ala-Gln и Gly-Tyr , настой [2]
- Вал-Тир , гипотензивное средство
Другие дипептиды [ править ]
- Гомоансерин ( N- (4-аминобутирил) -L- гистидин) - еще один дипептид, обнаруженный в мозге и мышцах млекопитающих.
- Киоторфин ( L- тирозил- L- аргинин) представляет собой нейроактивный дипептид, который играет роль в регуляции боли в головном мозге.
- Баленин (или офидин) ( бета- аланил- N тау -метилгистидин ) был обнаружен в мышцах нескольких видов млекопитающих (включая человека) и курицы .
- Glorin ( N пропионил-γ- L -glutamyl- л этилового эфира -ornithine-δ-ЛАК) является хемотаксическая дипептид для слизи плесени Polysphondylium violaceum .
- Бареттин (цикло - [(6-бром-8-эн-триптофан) -аргинин]) представляет собой циклический дипептид из морской губки Geodia barretti .
- Псевдопролин
- Диаланин обычно используется в качестве модели в молекулярной динамике .
Производство [ править ]
Синтетические дипептиды [ править ]
Дипептиды производятся связыванием аминокислот. Аминогруппа одной аминокислоты становится ненуклеофильной (P в экв.), А группа карбоновой кислоты во второй аминокислоте дезактивируется как ее метиловый эфир. Затем две модифицированные аминокислоты объединяют в присутствии связующего агента, который облегчает образование амидной связи:
- RCH (NHP) CO 2 H + R'CH (NH 2 ) CO 2 CH 3 → RCH (NHP) C (O) NH (CHR ') CO 2 CH 3 + H 2 O
После этой реакции сочетания аминозащитная группа P и сложный эфир превращаются в свободный амин и карбоновую кислоту соответственно. [3]
Для многих аминокислот вспомогательные функциональные группы защищены . При конденсации амина и карбоновой кислоты с образованием пептидной связи обычно используются связующие агенты для активации карбоновой кислоты. [4]
Азлактоновый синтез пептидов Бергманна является классическим органическим синтезом для получения дипептидов. [1]
Биосинтез [ править ]
Дипептиды производятся из полипептидов под действием фермента гидролазы дипептидилпептидазы . [5] Пищевые белки перевариваются до дипептидов и аминокислот, и дипептиды всасываются быстрее, чем аминокислоты, поскольку их поглощение включает отдельный механизм. Дипептиды активируют G-клетки, обнаруженные в желудке, для выделения гастрина .
Дикетопиперазины (циклические дипептиды) [ править ]
Дикетопиперазины представляют собой особый класс дипептидов, которые являются циклическими. Они образуются как побочные продукты при синтезе пептидов. Многие из них были произведены из неканонических аминокислот. [7]
Ссылки [ править ]
- ^ a b c d Ягасаки, Макото; Хашимото, Син-ичи (2008). «Синтез и применение дипептидов; современное состояние и перспективы». Из прикладной микробиологии и биотехнологии . 81 (1): 13–22. DOI : 10.1007 / s00253-008-1590-3 . PMID 18795289 .
- ^ a b Ферст, Питер; Поган, Карин; Стеле, Питер (1997). «Дипептиды глутамина в лечебном питании». Питание . 13 (7–8): 731–7. DOI : 10.1016 / S0899-9007 (97) 83035-3 . PMID 9263278 .
- ^ Субирос-Фуносас, Айман Эль-Фахам; Фернандо Альберисио (2013). «Образование пептидной связи с низкой эпимеризацией с помощью Oxyma Pure: получение ZL-Phg-Val-OMe». Орг. Synth . 90 : 306. DOI : 10,15227 / orgsyn.090.0306 .
- ^ Жан-Симон Суппо; Рената Марсия де Фигейредо; Жан-Марк Кампань (2015). «Синтезы дипептидов с помощью активированных α-аминоэфиров» . Орг. Synth . 92 : 296–308. DOI : 10.15227 / orgsyn.092.0296 .
- ^ Стейн, Ричард. «Гидролиз дипептида» . BioTopics . Проверено 28 июля 2014 .
- ^ Бортвик AD, Liddle J (январь 2013). «Ретосибан и Эпельсибан: мощные и селективные пероральные антагонисты окситоцина». В Domling A (ред.). Методы и принципы в медицинской химии: белок-белковые взаимодействия в открытии лекарств . Вайнхайм: Wiley-VCH. С. 225–256. ISBN 978-3-527-33107-9.
- ^ Бортвик, AD (2012). «2,5-Дикетопиперазины: синтез, реакции, медицинская химия и биоактивные натуральные продукты». Chem. Ред . 112 (7): 3641–716. DOI : 10.1021 / cr200398y . PMID 22575049 .
Внешние ссылки [ править ]
- Введение в дипептиды в PeptideGuide.