 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Дисилоксан | |
| Другие названия Дисилиловый эфир Дисилилоксид | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| Сокращения | DS DSE |
| ЧЭБИ | |
| ChemSpider | |
| 1206 | |
| MeSH | Дисилоксан |
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| H 6 O Si 2 | |
| Молярная масса | 78,217 г · моль -1 |
| Появление | Бесцветный газ |
| Точка кипения | -15,2 ° С (4,6 ° F, 257,9 К) |
| 0,24 Д | |
| Состав | |
| Орторомбический | |
| Pmm 2 | |
| Согнутый | |
| Опасности | |
| Паспорт безопасности | См .: страницу данных |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные соединения | Диметиловый эфир |
| Страница дополнительных данных | |
| Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | |
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ |
| УФ , ИК , ЯМР , МС | |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
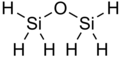
Дисилоксан имеет химическую формулу Si
2ЧАС
6O . Это простейший известный силоксан с R-группами, содержащими только водород. Молекула содержит шесть эквивалентных связей Si-H и две эквивалентные связи Si-O. Дисилоксан существует в виде бесцветного едкого газа при стандартных условиях. Однако, как правило, он безопасен для использования человеком, что свидетельствует о его широком использовании в косметике. Он также широко известен как дисилиловый эфир, дисилилоксид и пергидродисилоксан.
Структура [ править ]
Дисилоксан имеет простую структуру, состоящую из силоксановой связи (Si-O-Si) и водородных R-групп.
Структура дисилоксана изучалась различными спектроскопическими методами, такими как электронная дифракция, дипольный момент и ядерный магнитный резонанс. Обычно изучаются валентные углы связи Si-O-Si из-за их необычной природы. Эти связи обычно имеют валентные углы, которые больше среднего, от 130 до 160 градусов, большие длины связей не редкость. Типичные валентные углы с атомами кислорода составляют от 105 до 125 градусов, что соответствует гибридным s и p.орбитали. Аномально большой угол связи заставил некоторых ученых поверить в то, что молекула имеет линейную геометрию, в то время как другие собрали данные, указывающие на то, что дисилоксан имеет изогнутую геометрию. Это расхождение обычно зависит от спектроскопической техники, используемой для анализа соединения. Необычный валентный угол может быть связан с неподеленным электронным взаимодействием кислорода с d- орбиталями кремния. Было подсчитано, что каждая из двух неподеленных пар кислорода примерно на 50% вовлечена во взаимодействия π-связей с d- орбиталями кремния . Также есть свидетельства π-связи между p и dорбитали, что приводит к укорачиванию связи между Si-O, что улучшает перекрытие и общую стабильность молекулы. Из-за этого укорочения связи Si-O могут демонстрировать некоторое поведение частичных двойных связей.
В дополнение к исследованиям валентных углов, колебательный анализ также проводился для определения элементов симметрии дисилоксана. ИК-спектроскопия и спектроскопия комбинационного рассеяния были использованы, чтобы предложить точечную группу D 3d .
Синтез [ править ]
Синтез дисилоксана обычно осуществляется путем взятия разновидностей гидросилана с уходящей группой заместителя и его реакции с водой с образованием силанола. Затем силанол реагирует сам с собой с образованием конечного дисилоксана посредством дегидрогенизирующего связывания. Это показано в приведенных ниже реакциях:
H 3 SiX + H 2 O → H 3 SiOH + HX (первая стадия)
2 H 3 SiOH → H 3 SiOSiH 3 + H 2 O (вторая стадия)
Другие методы синтеза включают использование золота на углероде в качестве катализатора реакции, проводимой в воде, а также окисление гидросиланов, катализируемое InBr 3 .
Использует [ редактировать ]
Дисилоксаны можно использовать в качестве герметиков для строительства, красок, красок и покрытий, косметики, механических жидкостей, текстильных изделий и покрытий для бумаги.
Коммерческое использование дисилоксана широко распространено в косметике. Он обычно содержится в таких продуктах, как солнцезащитный крем, увлажняющий крем, лак для волос, подводка для глаз, спрей для тела, лак для ногтей, средство для снятия макияжа и кондиционер. Свойства, которые дисилоксан проявляет в этих продуктах, включают быстрое высыхание, уменьшение количества масел, увлажнение, кондиционирование кожи и пеногаситель (предотвращающий образование пены).
Дисилоксаны одобрены как безопасные для подростков и детей. Установлено, что многие виды силоксанов чрезвычайно безопасны для местного применения, но могут быть опасны при проглатывании.
Варианты [ править ]
Термин дисилоксан обычно используется для обозначения структур, которые имеют гораздо более сложные R-группы, чем водород. Наиболее распространенной молекулой, использующей это название, является гексаметилдисилоксан, который заменяет водородные группы метильными группами. Другие распространенные варианты включают использование дисилоксанов в качестве мостиков и прокладок в более крупных соединениях, таких как полимеры.
Ссылки [ править ]
Эта статья включает в себя список литературы , связанной литературы или внешних ссылок , но ее источники остаются неясными, поскольку в ней отсутствуют встроенные цитаты . ( Ноябрь 2018 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
- Sawama, Y .; Масуда, М .; Yasukawa, N .; Nakatani, R .; Nishimura, S .; Shibata, K .; Yamada, T .; Monguchi, Y .; Suzuka, H .; Takagi, Y .; Саджики, Х. Журнал органической химии, 2016 г., 81 , 4190-4195.
- Дисилоксан https://pubchem.ncbi.nlm.nih.gov/compound/Disiloxane (по состоянию на 23 марта 2018 г.).
- Lassen, C .; Hansen, C .; Mikkelsen, S .; Мааг, Дж. Силоксаны - потребление, токсичность и альтернативы ; Министерство окружающей среды Дании, 2018.
- Almennigen, A .; Bastiansen, O .; Юинг, В .; Hedberg, K .; Треттеберг, М. ACTA Chemica Scandinavica 2018, 17 , 2455-2460.
- Лорд, Р .; Робинсон, Д .; Schumb, W. Journal of the American Chemical Society 1956, 78 , 1327-1332.
- Barrow, M .; Ebsworth, E .; Хардинг, М. Acta Crystallographica Раздел B Структурная кристаллография и кристаллохимия 1979, 35 , 2093-2099.
- Varma, R .; MacDiarmid, A .; Миллер, Дж. Неорганическая химия 1964, 3 , 1754-1757.
- BOCK, H .; MOLLERE, P .; BECKER, G .; FRITZ, G. Chemischer Informationsdienst 1974, 5 , 113-125.
- Дисилоксан | H6OSi2 | ChemSpider http://www.chemspider.com/Chemical-Structure.109921.html (по состоянию на 23 марта 2018 г.).
