 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Тигасон, ранее Тегисон |
| AHFS / Drugs.com | Архив Drugs.com |
| MedlinePlus | a601010 |
| Пути администрирования | Устный |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетические данные | |
| Связывание с белками | > 99% |
| Метаболиты | Свободная кислота, Z- форма, укорачивание цепи |
| Ликвидация Период полураспада | 120 дней |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard | 100.053.727 |
| Химические и физические данные | |
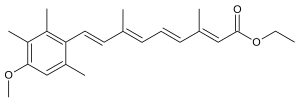
| Формула | С 23 Н 30 О 3 |
| Молярная масса | 354,490 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
| | |
Этретинат (торговое название Тегисон ) - это лекарство, разработанное Hoffmann-La Roche, которое было одобрено FDA в 1986 году для лечения тяжелого псориаза . Это ретиноид второго поколения . [1] Впоследствии он был удален с канадского рынка в 1996 году и рынка США в 1998 году из-за высокого риска врожденных дефектов. Он остается на рынке Японии как Тигасон .
Фармакология [ править ]
Этретинат является весьма липофильным , ароматическим ретиноидом. Он сохраняется и высвобождается из жировой ткани , поэтому его действие может продолжаться еще долго после прекращения приема препарата. Он обнаруживается в плазме до трех лет после терапии. Этретинат имеет низкий терапевтический индекс и длительный период полувыведения ( t 1/2 ) 120 дней [1], что затрудняет дозирование.
Этретинат был заменен ацитретином , свободной кислотой (без этилового эфира). Хотя ацитретин менее липофильный и имеет период полувыведения всего 50 часов, он частично метаболизируется в этретинат в организме [1], так что он все еще является тератогеном длительного действия, и беременность запрещена в течение двух лет после терапии. [2]
Меры предосторожности [ править ]
- Этретинат является тератогеном и может вызывать врожденные дефекты спустя долгое время после использования. Поэтому во время терапии и в течение как минимум трех лет после ее прекращения рекомендуется контролировать рождаемость. [3]
- Этретинат следует избегать детям , так как он может мешать росту костей . [3]
- Если пациент когда-либо принимал этретинат, он или она не имеет права сдавать кровь в США, Великобритании или Квебеке из-за риска врожденных дефектов. [4] [5] В Японии люди не могут сдавать кровь в течение двух лет после прекращения приема лекарства. [6]
Побочные эффекты [ править ]
Побочные эффекты являются типичными для гипервитаминоза А , наиболее часто [3]
- боль в костях или суставах, скованность; при длительном лечении диффузный идиопатический гиперостоз скелета
- мышечные или абдоминальные спазмы
- сухие, жгучие, зудящие веки
- необычный синяк
История [ править ]
Препарат был одобрен FDA в 1986 году для лечения тяжелого псориаза . Впоследствии он был удален с канадского рынка в 1996 году и с рынка США в 1998 году из-за высокого риска врожденных дефектов. [3] [7] [8]
В Японии препарат остается на рынке под торговой маркой Tigason . [6]
См. Также [ править ]
- Изотретиноин
- Список изъятых препаратов
Ссылки [ править ]
- ^ a b c Mutschler E, Schäfer-Korting M (2001). Arzneimittelwirkungen (на немецком языке) (8 изд.). Штутгарт: Wissenschaftliche Verlagsgesellschaft. п. 728f. ISBN 3-8047-1763-2.
- ^ Jasek W, изд. (2007). Кодекс Австрии (на немецком языке) (62-е изд.). Вена: Österreichischer Apothekerverlag. п. 5669. ISBN 978-3-85200-181-4.
- ^ a b c d Архив Drugs.com для этретината
- ^ «Рекомендации по выбору доноров: этретинат» . Службы переливания крови и трансплантации тканей Великобритании .
- ^ «Регулярно принимаемые лекарства, исключающие возможность сдачи крови» . Хема-Квебек .
- ^ a b «Информационный бюллетень по препарату Тигасон» . Совет RAD-AR Япония . Архивировано из оригинального 27 января 2013 года.
- ^ Куреши ЗП, Сеоан-Vazquez E, Rodriguez-Monguio R, Стивенсон KB, Szeinbach SL (июль 2011). «Вывод на рынок новых молекулярных объектов одобрен в США с 1980 по 2009 год». Фармакоэпидемиология и безопасность лекарств . 20 (7): 772–7. DOI : 10.1002 / pds.2155 . PMID 21574210 .
- ^ Фунг М, Торнтон А, Mybeck К, В JH, Hornbuckle К, Муниз Е (1 январь 2001 года). «Оценка характеристик безопасности вывода рецептурных лекарственных средств с мировых фармацевтических рынков с 1960 по 1999 годы». Терапевтические инновации и нормативная наука . 35 (1): 293–317. DOI : 10.1177 / 009286150103500134 . S2CID 73036562 .