Эта статья требует дополнительных ссылок для проверки . ( май 2014 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
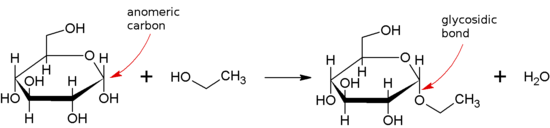
Гликозидная связь или гликозидная связь представляет собой тип ковалентной связи , который присоединяется к углеводу (сахар) молекулы к другой группе, которая может быть или не может быть другими углеводами.
Гликозидная связь образуется между полуацетальной или гемикетальной группой сахарида (или молекулой, производной от сахарида) и гидроксильной группой некоторого соединения, такого как спирт . Вещество, содержащее гликозидную связь, представляет собой гликозид .
Термин «гликозид» теперь расширен, чтобы также охватывать соединения со связями, образованными между полуацетальными (или гемикетальными) группами сахаров и несколькими химическими группами, отличными от гидроксилов, такими как -SR (тиогликозиды), -SeR (селеногликозиды), -NR 1 R. 2 (N-гликозиды) или даже -CR 1 R 2 R 3 (C-гликозиды).
В частности, в встречающихся в природе гликозидах соединение ROH, из которого был удален углеводный остаток, часто называют агликоном, а сам углеводный остаток иногда называют «гликоном».
S-, N-, C- и O-гликозидные связи [ править ]
Гликозидные связи обсуждаемой выше формы известны как О-гликозидные связи по отношению к гликозидному кислороду, который связывает гликозид с агликоном или восстанавливающим концевым сахаром. По аналогии, можно также рассматривать S-гликозидные связи (которые образуют тиогликозиды ), где кислород гликозидной связи заменен атомом серы . Таким же образом в N-гликозидных связях кислород гликозидной связи заменяется азотом . Вещества, содержащие N-гликозидные связи, также известны как гликозиламины . В С-гликозильных связях гликозидный кислород заменен углеродным; Термин «С-гликозид» IUPAC считает неправильным и не приветствуется. [1] Все эти модифицированные гликозидные связи имеют разную восприимчивость к гидролизу, а в случае C-гликозильных структур они обычно более устойчивы к гидролизу.
Нумерация и различие α / β гликозидных связей [ править ]
Различает альфа- и бета-гликозидных связи по относительной стереохимии позиции аномерной и стереоцентру дальних от С1 в сахариде. [2] α-гликозидная связь образуется, когда оба атома углерода имеют одинаковую стереохимию, тогда как β-гликозидная связь возникает, когда два атома углерода имеют разную стереохимию. Одна из сложных проблем состоит в том, что альфа- и бета-конформации были изначально определены на основе относительной ориентации основных составляющих в проекции Хаворта. В этом случае для D-сахаров, бета-конформация будет видеть основную составляющую на каждом углероде, нарисованном над плоскостью кольца (номинально такая же конформация), в то время как альфа будет видеть аномерный составляющий под кольцом (номинально противоположные конформации). Для L- сахаров определения тогда обязательно будут обратными. Это стоит отметить, поскольку эти старые определения все еще пронизывают литературу и могут привести к путанице.
Фармакологи часто присоединяют вещества к глюкуроновой кислоте через гликозидные связи, чтобы повысить их растворимость в воде ; это известно как глюкуронизация . Многие другие гликозиды выполняют важные физиологические функции.
Химические подходы [ править ]
Nüchter et al. (2001) продемонстрировали новый подход к гликозидации Фишера . [3] [4] [5] Используя микроволновую печь, оборудованную дефлегматором, в роторном реакторе с бомбами высокого давления , Nüchter et al. (2001) смогли достичь 100% выхода α- и β-D-глюкозидов. Этот метод можно выполнять в многокилограммовой шкале.
- Метод Вишала Й Джоши
Джоши и др. (2006) [6] предлагают метод Кенигса-Кнорра в стереоселективном синтезе алкил-D-глюкопиранозидов посредством гликозилирования, за исключением использования карбоната лития, который менее дорог и токсичен, чем традиционный метод с использованием солей серебра или ртути . D-глюкоза сначала защищается путем образования перацетата добавлением уксусного ангидрида в уксусной кислоте , а затем добавлением бромистого водорода.который бромирует в 5-м положении. При добавлении спирта ROH и карбоната лития OR заменяет бром, и при снятии защиты с ацетилированных гидроксилов продукт синтезируется с относительно высокой чистотой. Было предложено Joshi et al. (2001), что литий действует как нуклеофил, который атакует углерод в положении 5, и в переходном состоянии спирт замещает группу брома. Преимущества этого метода, а также его стереоселективность и низкая стоимость литиевой соли включают то, что его можно проводить при комнатной температуре, а его выход относительно хорошо сравнивается с традиционным методом Кенигса-Кнорра. [7]
Гликозид гидролазы [ править ]
Гликозидгидролазы (или гликозидазы) - это ферменты , разрушающие гликозидные связи. Гликозидгидролазы обычно могут действовать либо на α-, либо на β-гликозидные связи, но не на оба. Эта специфичность позволяет исследователям получать гликозиды в высоком эпимерном избытке, одним из примеров является превращение Wen-Ya Lu D-глюкозы в этил-β-D-глюкопиранозид с использованием глюкозидазы природного происхождения. Стоит отметить, что Wen-Ya Lu использовала глюкозидазу обратным образом, противоположным биологической функциональности фермента: [8]
Гликозилтрансферазы [ править ]
Прежде чем моносахаридные единицы будут включены в гликопротеины, полисахариды или липиды в живых организмах, они обычно сначала «активируются» путем присоединения через гликозидную связь к фосфатной группе нуклеотида, такого как дифосфат уридина (UDP), дифосфат гуанозина (GDP) , тимидиндифосфат (TDP) или цитидинмонофосфат (CMP). Эти активированные биохимические промежуточные продукты известны как сахарные нуклеотиды или доноры сахара. Во многих биосинтетических путях используются моно- или олигосахариды, активируемые дифосфатной связью с липидами, такими как долихол.. Эти активированные доноры затем являются субстратами для ферментов, известных как гликозилтрансферазы , которые переносят сахарную единицу от активированного донора к принимающему нуклеофилу (акцепторный субстрат).
Дисахарид фосфорилазы [ править ]
В последние десятилетия были разработаны различные биокаталитические подходы к синтезу гликозидов, которые с использованием «гликозилтрансфераз» и «гликозидгидролаз» являются одними из наиболее распространенных катализаторов. Первому часто требуются дорогие материалы, а второму - низкая урожайность, Де Винтер и др. [9] исследовали использование целлобиозофосфорилазы (ЦФ) для синтеза альфа-гликозидов в ионных жидкостях. Было обнаружено, что наилучшие условия для использования CP были в присутствии IL AMMOENG 101 и этилацетата.
Направленное гликозилирование [ править ]
Существует множество химических подходов, способствующих селективности α- и β-гликозидных связей. Высокосубстратно-специфический характер селективности и общей активности пиранозида может создавать серьезные трудности при синтезе. Общая специфичность гликозилирования может быть улучшена путем использования подходов, которые принимают во внимание относительные переходные состояния, в которых аномерный углерод может претерпевать во время типичного гликозилирования. В частности, признание и включение моделей Фелкина-Ан-Эйзенштейна в обоснование химического дизайна в целом может обеспечить надежные результаты при условии, что преобразование может подвергаться такому типу конформационного контроля в переходном состоянии.
Фтор-направленное гликозилирование является обнадеживающим средством как для селективности B, так и для введения неприродной биомиметической C2-функциональности в углевод. Один новаторский пример, представленный Bucher et al. обеспечивает способ использования иона фтора оксония и трихлорацетимидата для усиления стереоселективности B за счет гош-эффекта. Эта разумная стереоселективность очевидна при визуализации моделей Фелкина-Ана возможных форм стульев.
Этот метод представляет собой обнадеживающий способ селективного включения B-этила, изопропила и других гликозидов с типичным химическим составом трихлорацетимидата.
О-связанные гликопептиды; фармацевтическое применение О-гликозилированных пептидов [ править ]
Недавно было показано, что О-связанные гликопептиды демонстрируют превосходную проницаемость для ЦНС и эффективность на множестве животных моделей с болезненными состояниями. Кроме того, одним из наиболее интригующих аспектов этого является способность O-гликозилирования увеличивать период полужизни, уменьшать клиренс и улучшать PK / PD своего активного пептида за пределами увеличения проникновения в ЦНС. Врожденное использование сахаров в качестве солюбилизирующих фрагментов в метаболизме в фазах II и III (глюкуроновые кислоты) значительно дало эволюционное преимущество в том, что ферменты млекопитающих не эволюционируют напрямую для разложения О-гликозилированных продуктов на более крупные фрагменты.
Своеобразная природа О-связанных гликопептидов состоит в том, что существует множество примеров, которые проникают в ЦНС. Считается, что фундаментальная основа этого эффекта связана с «прыжками через мембрану» или «диффузией хмеля». Считается, что процесс «диффузии хмеля», вызванный неброуновским движением, происходит из-за разрыва плазматической мембраны. «Диффузия хмеля» особенно сочетает свободную диффузию и межсравнительные переходы. Недавние примеры, в частности, включают высокую проницаемость аналогов мет-энкефалина среди других пептидов. Полный агонист mOR пентапептид DAMGO также проникает в ЦНС при гликозилировании. [10] [11] [12] [13]
Ссылки [ править ]
- ^ «Номенклатура углеводов (Рекомендации 1996 г.)» . Химический факультет Лондонского университета королевы Марии .
- ^ Бертоцци, Кэролайн; Рабука, Дэвид (2009). «Структурные основы разнообразия гликанов» . Основы гликобиологии. 2-е издание . NCBI . Национальный центр биотехнологической информации, Национальная медицинская библиотека США. ISBN 9780879697709.
- ^ Фишер, Эмиль (1893). "Ueber die Glucoside der Alkohole" . Berichte der deutschen chemischen Gesellschaft . 26 (3): 2400–2412. DOI : 10.1002 / cber.18930260327 .
- ^ Фишер, Эмиль (1895). "Ueber die Verbindungen der Zucker mit den Alkoholen und Ketonen" . Berichte der Deutschen Chemischen Gesellschaft . 28 (1): 1145–1167. DOI : 10.1002 / cber.189502801248 . ISSN 1099-0682 .
- ^ Нюхтер, Маттиас; Ондрушка, Бернд; Лаутеншлегер, Вернер (2001). «Микроволновый синтез алкилгликозидов». Синтетические коммуникации . 31 (9): 1277–1283. DOI : 10,1081 / SCC-100104035 . ISSN 0039-7911 .
- ^ Вишал Y Joshi, Manohar R Sawant (2006). «Удобный стереоселективный синтез β-D-глюкопиранозидов». Индийский журнал химии . 45B : 461–465.
- ^ Вильгельм Кенигс и Эдвард Норр (1901). "Ueber einige Derivate des Traubenzuckers und der Galactose (p)". Berichte der deutschen chemischen Gesellschaft 34 (1): 957–981.
- ^ а б Вэнь-Я Лу, Го-Цян Линь, Хуэй-Лей Ю, Ай-Мин Тонг, Цзянь-Хэ Сюй (2009-12-09). Уиттолл Дж., Саттон П.В. (ред.). Практические методы биокатализа и биотрансформации . Джон Вили и сыновья. С. 236–239. ISBN 978-0-470-74859-6.
- ^ Де Винтер, Карел; Ван Рентергем, Лиза; Вуйтс, Кэтлин; Пелантова, Елена; Крен, Владимир; Soetaert, Wim; Десмет, Том (2015). «Хемоферментный синтез β-D глюкозидов с использованием целлобиозофосфорилазы из Clostridium thermocellum». Расширенный синтез и катализ . 357 (8): 1961–1969. DOI : 10.1002 / adsc.201500077 . ISSN 1615-4150 .
- ^ Эглетон, Ричард Д; Митчелл, Скотт А; Хубер, Джейсон Д; Джандерс, Жаклин; Стропова, Дагмар; Полт, Робин; Ямамура, Генрих I; Hruby, Виктор Дж; Дэвис, Томас П (2000-10-20). «Повышенная биодоступность для мозга аналогов гликозилированного мет-энкефалина». Исследование мозга . 881 (1): 37–46. DOI : 10.1016 / S0006-8993 (00) 02794-3 . PMID 11033091 .
- ^ Полт, Робин; Дханасекаран, Мутху; Кейари, Чарльз М. (1 сентября 2005 г.). «Гликозилированные нейропептиды: новая перспектива нейропсихофармакологии?». Обзоры медицинских исследований . 25 (5): 557–585. DOI : 10.1002 / med.20039 . ISSN 0198-6325 . PMID 16075406 .
- ^ Полт, Робин; Дханасекаран, Мутху; Кейари, Чарльз М. (1 сентября 2005 г.). «Гликозилированные нейропептиды: новая перспектива нейропсихофармакологии?». Обзоры медицинских исследований . 25 (5): 557–585. DOI : 10.1002 / med.20039 . ISSN 1098-1128 . PMID 16075406 .
- ^ Egleton, Ричард Д .; Бильский, Эдвард Дж .; Толлин, Гордон; Дханасекаран, Мутху; Лоури, Джон; Алвес, Изабель; Дэвис, Пег; Поррека, Франк; Ямамура, Генри I. (10 января 2005 г.). «Биоциановые гликопептиды проникают через гематоэнцефалический барьер». Тетраэдр: асимметрия . Наука об углеводах. Часть 1. 16 (1): 65–75. DOI : 10.1016 / j.tetasy.2004.11.038 .
- Марко Брито-Ариас, «Синтез и характеристика гликозидов», второе издание, редакция Springer, 2016 г.
Внешние ссылки [ править ]
- Определение гликозидов из Компендиума химической терминологии ИЮПАК , « Золотая книга »
- Варки А. и соавт. Основы гликобиологии. Лабораторный пресс Колд-Спринг-Харбор; 1999. Доступен для поиска в Интернете.