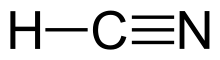 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| 3DMet | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.747 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| MeSH | Водород + Цианид | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1051 | ||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| HCN | |||
| Молярная масса | 27,0253 г / моль | ||
| Внешность | Бесцветная жидкость или газ | ||
| Запах | Масло горького миндаля | ||
| Плотность | 0,6876 г / л [3] | ||
| Температура плавления | -13,29 ° С (8,08 ° F, 259,86 К) [3] | ||
| Точка кипения | 26 ° С (79 ° F, 299 К) [3] : 4,67 | ||
| Смешиваемый | |||
| Растворимость в этаноле | Смешиваемый | ||
| Давление газа | 100 кПа (25 ° C) [3] : 6,94 | ||
Константа закона Генри ( k H ) | 75 мкмоль Па −1 кг −1 | ||
| Кислотность (p K a ) | 9,21 (в воде), 12,9 (в ДМСО) [4] | ||
| Основность (p K b ) | 4,79 (цианид-анион) | ||
| Конъюгированная кислота | Гидроцианоний | ||
| Основание конъюгата | Цианид | ||
Показатель преломления ( n D ) | 1,2675 [5] | ||
| Вязкость | 0,183 мПа · с (25 ° C) [3] : 6,231 | ||
| Структура | |||
Группа точек | C ∞v | ||
Молекулярная форма | Линейный | ||
Дипольный момент | 2.98 D | ||
| Термохимия | |||
Теплоемкость ( C ) | 35,9 Дж · К -1 моль -1 (газ) [3] : 5,19 | ||
Стандартная мольная энтропия ( S | 201,8 Дж -1 моль -1 | ||
Std энтальпия формации (Δ F H ⦵ 298 ) | 135,1 кДж моль -1 | ||
| Опасности | |||
| Пиктограммы GHS | |||
| Сигнальное слово GHS | Опасность | ||
Формулировки опасности GHS | H225 , H300 , H310 , H319 , H330 , H336 , H370 , H400 , H410 | ||
Меры предосторожности GHS | P210 , P261 , P305 + 351 + 338 | ||
| NFPA 704 (огненный алмаз) |  4 4 2 | ||
| точка возгорания | -17,8 ° С (0,0 ° F, 255,3 К) | ||
самовоспламенения температуру | 538 ° С (1000 ° F, 811 К) | ||
| Пределы взрываемости | 5,6% - 40,0% [6] | ||
| Смертельная доза или концентрация (LD, LC): | |||
ЛК 50 ( средняя концентрация ) | 501 ppm (крыса, 5 мин) 323 ppm (мышь, 5 мин) 275 ppm (крыса, 15 мин) 170 ppm (крыса, 30 мин) 160 ppm (крыса, 30 мин) 323 ppm (крыса, 5 мин) [7 ] | ||
LC Lo ( самый низкий опубликованный ) | 200 ppm (млекопитающее, 5 мин) 36 ppm (млекопитающее, 2 часа) 107 ppm (человек, 10 мин) 759 ppm (кролик, 1 мин) 759 ppm (кошка, 1 мин) 357 ppm (человек, 2 мин) 179 ppm (человек, 1 час) [7] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 10 частей на миллион (11 мг / м 3 ) [кожа] [6] | ||
REL (рекомендуется) | ST 4,7 частей на миллион (5 мг / м 3 ) [кожа] [6] | ||
IDLH (Непосредственная опасность) | 50 частей на миллион [6] | ||
| Родственные соединения | |||
Родственные алканнитрилы |
| ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Цианистый водород , иногда называемый синильной кислотой , представляет собой химическое соединение [8] с химической формулой HCN. Это бесцветная , чрезвычайно ядовитая и легковоспламеняющаяся жидкость, которая кипит немного выше комнатной температуры и составляет 25,6 ° C (78,1 ° F). [9] HCN производится в промышленных масштабах и является очень ценным предшественником многих химических соединений, от полимеров до фармацевтических препаратов.
Структура и общие свойства [ править ]
Цианистый водород - это линейная молекула с тройной связью между углеродом и азотом. Минорный таутомер HCN - это HNC, изоцианид водорода .
Цианистый водород является слабокислым с p K a 9,2. Он частично ионизируется в водном растворе с образованием цианид- аниона CN - . Раствор цианистого водорода в воде , представлена в виде HCN, называется синильной кислотой . В соли цианида аниона известна как цианиды.
HCN имеет слабый горький миндаль -like запаха , что некоторые люди не может обнаружить из - за рецессивный генетический признак . [10] летучее соединение используется в качестве ингаляционного родентицида и человеческого яда, а также за убийство китов. [11] Ионы цианида мешают железосодержащим респираторным ферментам.
История открытия [ править ]
Цианистый водород был впервые выделен из синего пигмента ( берлинской лазурь ), известного с 1706 года, но структура которого была неизвестна. В настоящее время известно, что это координационный полимер со сложной структурой и эмпирической формулой гидратированного ферроцианида трехвалентного железа . В 1752 году французский химик Пьер Маккер сделал важный шаг, продемонстрировав, что берлинская лазурь может быть преобразована в оксид железа плюс летучий компонент и что их можно использовать для его восстановления. [12] Новым компонентом был так называемый цианистый водород. Следуя примеру Макера, он был впервые приготовлен из берлинской синей шведским химиком Карлом Вильгельмом Шееле в 1782 году.[13] и в конечном итоге получил немецкое название Blausäure ( букв . «Синяя кислота») из-за ее кислой природы в воде и ее производного от берлинской синевы. На английском языке она стала известна как синильная кислота.
В 1787 году французский химик Клод Луи Бертолле показал, что синильная кислота не содержит кислорода [14], что является важным вкладом в теорию кислот, которая до сих пор постулировала, что кислоты должны содержать кислород [15] (отсюда и название самого кислорода , которое является производный от греческих элементов, средний «кислотно-бывший» и также calqued на немецкий язык , как Sauerstoff ). В 1811 году Жозеф Луи Гей-Люссак получил чистый жидкий цианистый водород. [16] В 1815 году Гей-Люссак вывел химическую формулу синильной кислоты. [17] Цианистый радикал в цианистом водороде получил свое название от циана., не только английское слово, обозначающее оттенок синего, но и греческое слово, обозначающее синий ( древнегреческий : κύανος ), опять же из-за его происхождения от берлинского голубого.
Производство и синтез [ править ]
Цианистый водород образуется, по крайней мере, в ограниченных количествах из многих комбинаций водорода, углерода и аммиака . Цианистый водород в настоящее время производится в больших количествах с помощью нескольких процессов, а также является вторичным отходом производства акрилонитрила . [8] В 2006 году в США было произведено от 500 миллионов до 1 миллиарда фунтов (от 230 000 до 450 000 тонн). [18]
Наиболее важным процессом является окисление Андруссова, изобретенное Леонидом Андруссовым из IG Farben, при котором метан и аммиак реагируют в присутствии кислорода при температуре около 1200 ° C (2190 ° F) над платиновым катализатором: [19]
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
Энергия, необходимая для реакции, обеспечивается частичным окислением метана и аммиака.
Менее важен процесс Дегусса (процесс BMA ), в котором кислород не добавляется, а энергия должна передаваться косвенно через стенку реактора: [20]
- СН 4 + NH 3 → HCN + 3H 2
Эта реакция сродни паровой конверсии , реакции метана и воды с образованием окиси углерода и водорода .
В процессе Шавинигана углеводороды , например пропан , реагируют с аммиаком. В лаборатории небольшие количества HCN получают путем добавления кислот к цианидным солям щелочных металлов :
- Н + + NaCN → HCN + Na +
Эта реакция иногда является причиной случайных отравлений, поскольку кислота превращает нелетучую цианидную соль в газообразный HCN.
Исторические методы производства [ править ]
Большой спрос на цианиды для горных работ в 1890-х годах был удовлетворен Джорджем Томасом Бейлби , который запатентовал метод получения цианида водорода путем пропускания аммиака над раскаленным углем в 1892 году. Этот метод использовался до тех пор, пока Гамильтон Кастнер в 1894 году не разработал синтез, основанный на угле. , аммиак и натрий с образованием цианида натрия , который реагирует с кислотой с образованием газообразного HCN.
Приложения [ править ]
HCN является предшественником цианида натрия и цианида калия , которые используются главным образом в золотой и серебряной горнодобывающей промышленности и гальванических этих металлов. Посредством взаимодействия циангидринов из HCN получают различные полезные органические соединения, включая мономер метилметакрилат , из ацетона , аминокислоту метионин посредством синтеза Штрекера и хелатирующие агенты EDTA и NTA . Через гидроцианирование процесса, HCN , добавляет к бутадиену с получениемадипонитрил , предшественник нейлона-6,6 . [8]
Возникновение [ править ]
HCN , может быть получен из плодов , которые имеют яму , такие как вишня , абрикос , яблоки и горький миндаль , из которых изготовлены миндальное масло и ароматизатор. Многие из этих ямок содержат небольшое количество циангидринов, таких как миндонитрил и амигдалин , которые медленно выделяют цианистый водород. [21] [22] Из ста граммов измельченных семян яблока можно получить около 70 мг HCN. [23] Некоторые многоножки выделяют цианистый водород в качестве защитного механизма [24], как и некоторые насекомые, например, некоторыемоль . Цианистый водород содержится в выхлопных газах транспортных средств и в дыме от горящих азотсодержащих пластмасс . Так называемые «горькие» корни маниоки могут содержать до 1 грамма HCN на килограмм. [25] [26]
HCN на Титане [ править ]
HCN был измерен в атмосфере Титана четырьмя приборами космического зонда Кассини , одним прибором на " Вояджере" и одним прибором на Земле. [27] Одно из этих измерений было на месте, когда космический аппарат Кассини опустился на расстояние от 1000 до 1100 км (620 и 680 миль) над поверхностью Титана, чтобы собрать атмосферный газ для масс-спектрометрического анализа. [28] HCN первоначально образуется в атмосфере Титана в результате реакции фотохимически образованного метана и радикалов азота, которые проходят через промежуточное соединение H 2 CN, например (CH 3 + N → H 2 CN + H → HCN + H 2 ). [29][30] Ультрафиолетовое излучение расщепляет HCN на CN + H; однако CN эффективно рециркулируется обратно в HCN посредством реакции CN + CH 4 → HCN + CH 3 . [29]
HCN на молодой Земле [ править ]
Было высказано предположение, что углерод от каскада астероидов (известного как поздняя тяжелая бомбардировка ), возникшего в результате взаимодействия Юпитера и Сатурна, взорвал поверхность молодой Земли и вступил в реакцию с азотом в атмосфере Земли с образованием HCN. [31]
HCN у млекопитающих [ править ]
Некоторые авторы [ кто? ] показали, что нейроны могут продуцировать цианистый водород при активации своих опиоидных рецепторов эндогенными или экзогенными опиоидами. Они также показали, что продукция HCN нейронами активирует рецепторы NMDA и играет роль в передаче сигнала между нейрональными клетками ( нейротрансмиссия ). Более того, повышенная выработка эндогенного нейронального HCN под действием опиоидов, по-видимому, была необходима для адекватной опиоидной анальгезии , поскольку обезболивающее действие опиоидов ослаблялось поглотителями HCN. Они считали эндогенный HCN нейромодулятором. [32]
Также было показано, что, хотя стимуляция мускариновых холинергических рецепторов в культивируемых клетках феохромоцитомы увеличивает продукцию HCN, в живом организме ( in vivo ) мускариновая холинергическая стимуляция фактически снижает выработку HCN. [33]
Лейкоциты генерируют HCN во время фагоцитоза и могут убивать бактерии , грибки и другие патогены, производя несколько различных токсичных химических веществ, одним из которых является цианистый водород. [32]
Вазодилатации , вызванное нитропруссид натрия , как было показано, опосредуется не только генерации NO, но и эндогенным поколения цианид, который добавляет не только токсичность, но и некоторые дополнительные антигипертензивную эффективность по сравнению с нитроглицерином и другими не цианогенных нитраты , которые не вызывают повышается уровень цианида в крови. [34]
HCN входит в состав табачного дыма . [35]
HCN и происхождение жизни [ править ]
Цианистый водород обсуждался как предшественник аминокислот и нуклеиновых кислот, и предполагается, что он сыграл роль в происхождении жизни . [36] Хотя связь этих химических реакций с теорией происхождения жизни остается спекулятивной, исследования в этой области привели к открытиям новых путей к органическим соединениям, полученным при конденсации HCN (например, аденина ). [37]
HCN в космосе [ править ]
HCN обнаружен в межзвездной среде [38] и в атмосферах углеродных звезд . [39] С тех пор в ходе обширных исследований были изучены пути образования и разрушения HCN в различных средах и изучено его использование в качестве индикатора для различных астрономических видов и процессов. HCN можно наблюдать с помощью наземных телескопов через ряд атмосферных окон. [40] Все чисто вращательные переходы J = 1 → 0, J = 3 → 2, J = 4 → 3 и J = 10 → 9 наблюдались. [38] [41] [42]
HCN образуется в межзвездных облаках одним из двух основных путей: [43] через нейтрально-нейтральную реакцию (CH 2 + N → HCN + H) и через диссоциативную рекомбинацию (HCNH + + e - → HCN + H). Путь диссоциативной рекомбинации доминирует на 30%; однако HCNH + должен быть в линейной форме. Диссоциативная рекомбинация с его структурным изомером, H 2 NC + , дает исключительно изоцианид водорода (HNC).
HCN разрушается в межзвездных облаках с помощью ряда механизмов, зависящих от местоположения в облаке. [43] В областях с преобладанием фотонов (PDR) преобладает фотодиссоциация, производящая CN (HCN + ν → CN + H). На более глубоких глубинах преобладает фотодиссоциация космических лучей с образованием CN (HCN + cr → CN + H). В темном ядре его разрушают два конкурирующих механизма, образуя HCN + и HCNH + (HCN + H + → HCN + + H; HCN + HCO + → HCNH + + CO). Реакция с HCO +доминирует в ~ 3,5 раза. HCN использовался для анализа множества видов и процессов в межзвездной среде. Он был предложен в качестве индикатора для плотного молекулярного газа [44] [45] и в качестве индикатора притока звезд в области образования больших масс. [46] Кроме того, соотношение HNC / HCN оказалось отличным методом для различения PDR и областей с преобладанием рентгеновских лучей (XDR). [47]
11 августа 2014 года, астрономы выпустили исследования, используя Атакама Большой миллиметровый / субмиллиметровом Array (ALMA) в первый раз, что подробно описано распределение HCN, HNC , H 2 CO и пыли внутри волосяные семенные придатки из кометы C / 2012 F6 ( Lemmon) и C / 2012 S1 (ISON) . [48] [49]
В феврале 2016 года было объявлено, что следы цианистого водорода были обнаружены в атмосфере горячей Super-Earth 55 Cancri e с помощью космического телескопа Хаббла НАСА . [50]
Как яд и химическое оружие [ править ]
Во время Первой мировой войны цианистый водород использовался французами с 1916 года в качестве химического оружия против центральных держав , а также Соединенными Штатами и Италией в 1918 году. Из-за погодных условий он оказался недостаточно эффективным. [51] [52] Газ легче воздуха и быстро рассеивается в атмосфере. Быстрое разбавление сделало его использование в полевых условиях непрактичным. Напротив, более плотные агенты, такие как фосген или хлор, как правило, оставались на уровне земли и уходили в траншеи на полях сражений Западного фронта. По сравнению с такими агентами цианистый водород должен присутствовать в более высоких концентрациях, чтобы стать фатальным.
Концентрация цианистого водорода 100–200 частей на миллион в воздухе для дыхания убьет человека в течение 10–60 минут. [53] Концентрация цианистого водорода 2000 частей на миллион (около 2380 мг / м 3 ) убьет человека примерно за одну минуту. [53] Токсический эффект вызван действием иона цианида, который останавливает клеточное дыхание . Он действует как неконкурентный ингибитор фермента в митохондриях, называемого цитохром с оксидазой . Таким образом, цианистый водород обычно входит в список химического оружия как агент крови . [54]
В Конвенции о запрещении химического оружия списков его под Списком 3 в качестве потенциального оружия , которое имеет крупные промышленные применения. Подписавшие страны должны объявить заводы-производители, которые производят более 30 метрических тонн в год, и разрешить инспекции Организацией по запрещению химического оружия .
Поглощенный носителем цианистый водород может найти применение в качестве пестицида. Пожалуй, наиболее печально известные из них является Циклон Б (немецкий: Циклон Б , с B стоя на Blausäure - синильная кислота, а также, чтобы отличить его от более раннего продукта позже известным как Циклон А), [55] он был использован в нацистском немецком лагеря смерти во время Второй мировой войны , чтобы убить скопом как часть их окончательного решенияпрограмма геноцида. Цианистый водород также использовался в лагерях для дезинфекции одежды в попытках искоренить болезни, переносимые вшами и другими паразитами. Один из первых чешских производителей до недавнего времени продолжал производить Циклон Б под торговой маркой «Ураган Д2» [56] . [ когда? ]
Цианистый водород также использовался в судебных казнях в некоторых штатах США , где он был получен во время казни действием серной кислоты на цианид натрия или калия .
Под названием синильная кислота HCN использовалась в качестве смертоносного средства в китобойных гарпунах, хотя она оказалась довольно опасной для экипажа, использовавшего ее, и от нее быстро отказались. [11] С середины 18 века он использовался для отравления, убийств и самоубийств. [57]
Цианистый водород в воздухе взрывоопасен при концентрациях выше 5,6%. [58] Эта концентрация намного выше токсичного уровня.
Ссылки [ править ]
- ^ "Цианистый водород - Резюме соединения" . PubChem Compound . США: Национальный центр биотехнологической информации. 16 сентября 2004 г. Опознание . Проверено 4 июня 2012 .
- ^ "цианистый водород (CHEBI: 18407)" . Химические объекты, представляющие биологический интерес . Великобритания: Европейский институт биоинформатики. 18 октября 2009 г. Главная . Проверено 4 июня 2012 .
- ^ a b c d e f Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). CRC Press . ISBN 978-1439855119.
- ^ Эванс, Д.А. "pKa неорганических и оксокислот" (PDF) . Проверено 19 июня 2020 года .
- ^ Patnaik, P. (2002). Справочник неорганических химикатов . Макгроу-Хилл. ISBN 978-0-07-049439-8.
- ^ a b c d Карманный справочник NIOSH по химической опасности. «# 0333» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b «Цианистый водород» . Немедленно опасные для жизни или здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b c Гейл, E .; Гос, С .; Kulzer, R .; Lorösch, J .; Rubo, A .; Зауэр, М. "Циано-соединения, неорганические". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a08_159.pub2 .CS1 maint: несколько имен: список авторов ( ссылка )
- ^ "Wolfram-Alpha: вычислительная машина знаний" .
- ^ «Цианид, отсутствие запаха» . Интернет-Менделирующее наследование в человеке . Проверено 31 марта 2010 .
- ^ a b Литл, Томас. «Ядовитые гарпуны» . Whalecraft.net . Архивировано из оригинала на 2019-02-15.
- ^ Macquer, Пьер-Жозеф (представлены: 1752, опубликована: 1756) "Экзамен chymique де блю де Prusse" (химическая экспертиза берлинской лазури), Мемуары де l'Académie Royale дез наук , С. 60-77..
- ^ Шееле, Карлы В. (1782) "Försök, beträffande ого färgande AMNET ИМП Berlinerblå" (эксперименткасающиеся окраски вещества в берлинской лазури), Kungliga Svenska Vetenskapsakademiens handlingar (Royal Swedish Academy Трудов Науки), 3 : 264-275 (в Шведский).
Перепечатано на латыни как: «De materia tingente caerulei berolinensis» в: Карл Вильгельм Шееле с Эрнстом Бенджамином Готтлибом Хебенштрайтом (ред.) И Готфридом Генрихом Шефер (перевод), Opuscula Chemica et Physica (Лейпциг («Липсии)»), («Lipsiae») : Иоганн Годфрид Мюллер, 1789), т. 2, страницы 148–174. - ↑ Berthollet, CL (представлено: 1787; опубликовано: 1789) «Mémoire sur l'acide prussique» (Воспоминания о синильной кислоте), Mémoires de l'Académie Royale des Sciences , страницы 148–161.
Перепечатано в: Berthollet, CL (1789). «Extrait d'un mémoire sur l'acide prussique» [Отрывок из воспоминаний о синильной кислоте]. Annales de Chimie . 1 : 30–39. - ^ Newbold, BT (1999-11-01). «Клод Луи Бертолле: великий химик французской традиции» . Канадские химические новости . Проверено 31 марта 2010 .
- Перейти ↑ Gay-Lussac, JL (1811). «Note sur l'acide prussique» [Примечание о синильной кислоте]. Annales de Chimie . 44 : 128–133.
- ^ Гей-Люссак, JL (1815). "Recherche sur l'acide prussique" [Исследование синильной кислоты]. Annales de Chimie . 95 : 136–231.
- ^ Неконфиденциальные 2006 МСР отчетов по химическому, включая производство, обработку и использование информацию . EPA. Проверено 31 января 2013.
- ^ Andrussow, L. (1935). «Каталитическое окисление смесей аммиака и метана до цианистого водорода». Angewandte Chemie . 48 (37): 593–595. DOI : 10.1002 / ange.19350483702 .
- ^ Эндтер, Ф. (1958). "Die Technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff". Chemie Ingenieur Technik . 30 (5): 305–310. DOI : 10.1002 / cite.330300506 .
- Перейти ↑ Vetter, J. (2000). «Цианогенные гликозиды растений». Токсикон . 38 (1): 11–36. DOI : 10.1016 / S0041-0101 (99) 00128-2 . PMID 10669009 .
- ^ Джонс, DA (1998). «Почему так много цианогенных пищевых растений?». Фитохимия . 47 (2): 155–162. DOI : 10.1016 / S0031-9422 (97) 00425-1 . PMID 9431670 .
- ^ "Ядовиты ли ядра Apple?" . Голые ученые. 26 сентября 2010 года Архивировано из оригинала 6 марта 2014 года . Проверено 6 марта 2014 .
- ^ Блюм, MS; Вудринг, JP (1962). «Секреция бензальдегида и цианистого водорода многоножкой Pachydesmus crassicutis (древесина)». Наука . 138 (3539): 512–513. Bibcode : 1962Sci ... 138..512B . DOI : 10.1126 / science.138.3539.512 . PMID 17753947 . S2CID 40193390 .
- ^ Aregheore, EM; Агунбиад, О. О. (1991). «Токсическое воздействие диеты маниока ( Manihot esculenta Crantz) на людей: обзор». Ветеринария и токсикология человека . 33 (3): 274–275. PMID 1650055 .
- ^ Белый, WLB; Arias-Garzon, DI; МакМахон, Дж. М.; Сайр, RT (1998). «Цианогенез в маниоке, роль гидроксинитриллиазы в производстве цианида корня» . Физиология растений . 116 (4): 1219–1225. DOI : 10.1104 / pp.116.4.1219 . PMC 35028 . PMID 9536038 .
- ^ Луазон, JC; Hébrard, E .; Dobrijevic, M .; Хиксон, км; Каральп, F .; Hue, V .; Gronoff, G .; Venot, O .; Бенилан Ю. (февраль 2015 г.). «Нейтральная фотохимия нитрилов, аминов и иминов в атмосфере Титана». Икар . 247 : 218–247. Bibcode : 2015Icar..247..218L . DOI : 10.1016 / j.icarus.2014.09.039 .
- ^ Маги, Брайан А .; Уэйт, Дж. Хантер; Mandt, Kathleen E .; Вестлейк, Джозеф; Белл, Джаред; Гелл, Дэвид А. (декабрь 2009 г.). «Состав верхних слоев атмосферы Титана по данным INMS: методы анализа и сравнение моделей». Планетарная и космическая наука . 57 (14–15): 1895–1916. Bibcode : 2009P & SS ... 57.1895M . DOI : 10.1016 / j.pss.2009.06.016 .
- ^ а б Пирс, Бен KD; Молавердихани, Каран; Пудриц, Ральф; Хеннинг, Томас; Эбрар, Эрид (2020). «Производство HCN в атмосфере Титана: взаимодействие квантовой химии и моделирования неравновесной атмосферы» . Астрофизический журнал . 901 (2): 110. arXiv : 2008.04312 . DOI : 10.3847 / 1538-4357 / abae5c . S2CID 221095540 .
- ^ Пирс, Бен KD; Эйерс, Пол У .; Пудриц, Ральф Э. (20 февраля 2019 г.). «Согласованная сокращенная сеть для химии HCN в атмосферах ранней Земли и Титана: квантовые расчеты коэффициентов скорости реакции». Журнал физической химии . 123 (9): 1861–1873. arXiv : 1902.05574 . Bibcode : 2019JPCA..123.1861P . DOI : 10.1021 / acs.jpca.8b11323 . ISSN 1089-5639 . PMID 30721064 . S2CID 73442008 .
- ^ Уэйд, Николас (2015-05-04). «Осмысление химии, которая привела к жизни на Земле» . Нью-Йорк Таймс . Дата обращения 5 мая 2015 .
- ^ a b Боровиц JL, Gunasekar PG, Isom GE (12 сентября 1997 г.). «Генерация цианида водорода путем активации мю-опиатных рецепторов: возможная нейромодулирующая роль эндогенного цианида». Brain Res . 768 (1–2): 294–300. DOI : 10.1016 / S0006-8993 (97) 00659-8 . PMID 9369328 . S2CID 12277593 .
- ^ Gunasekar PG, Прабхакаран K, Li L, Чжан L, Isom GE, Borowitz JL (май 2004). «Рецепторные механизмы, обеспечивающие генерацию цианида в клетках PC12 и головном мозге крысы». Neurosci Res . 49 (1): 13–18. DOI : 10.1016 / j.neures.2004.01.006 . PMID 15099699 . S2CID 29850349 .
- ↑ Smith RP, Kruszyna H (январь 1976 г.). «Токсикология некоторых неорганических антигипертензивных анионов». Fed Proc . 35 (1): 69–72. PMID 1245233 .
- ^ Talhout, Reinskje; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхёйзен, Антун (2011). «Опасные соединения в табачном дыме» . Международный журнал исследований окружающей среды и общественного здравоохранения . 8 (12): 613–628. DOI : 10.3390 / ijerph8020613 . ISSN 1660-4601 . PMC 3084482 . PMID 21556207 .
- Перейти ↑ Matthews, CN (2004). «Мир HCN: Установление жизни белков и нуклеиновых кислот с помощью полимеров цианида водорода». Происхождение: генезис, эволюция и разнообразие жизни . Клеточное происхождение и жизнь в экстремальных средах обитания и астробиологии. 6 . С. 121–135. DOI : 10.1007 / 1-4020-2522-X_8 . ISBN 978-1-4020-2522-8.
- ^ Аль-Азми, А .; Элассар, А.-ЗА; Бут, Б.Л. (2003). «Химия диаминомалеонитрила и его применение в гетероциклическом синтезе». Тетраэдр . 59 (16): 2749–2763. DOI : 10.1016 / S0040-4020 (03) 00153-4 .
- ^ а б Снайдер, LE; Буль, Д. (1971). «Наблюдения за радиоизлучением межзвездного цианида водорода». Астрофизический журнал . 163 : L47 – L52. Bibcode : 1971ApJ ... 163L..47S . DOI : 10.1086 / 180664 .
- ↑ Jørgensen, Uffe G. (1997), "Cool Star Models" , in van Dishoeck, Ewine F. (ed.), Molecules in Astrophysics: Probes and Processes , International Astronomical Union Symposia. Молекулы в астрофизике: зонды и процессы, 178 , Springer Science & Business Media, стр. 446, ISBN 978-0792345381.
- ^ Treffers, R .; Ларсон, HP; Финк, У .; Готье, TN (1978). «Верхние пределы для отслеживания составляющих в атмосфере Юпитера из анализа его 5-мкм спектра». Икар . 34 (2): 331–343. Bibcode : 1978Icar ... 34..331T . DOI : 10.1016 / 0019-1035 (78) 90171-9 .
- ^ Bieging, JH; Шакед, С .; Геншаймер, PD (2000). «Наблюдения в субмиллиметровом и миллиметровом диапазонах волн SiO и HCN в околозвездных оболочках звезд AGB» . Астрофизический журнал . 543 (2): 897–921. Bibcode : 2000ApJ ... 543..897B . DOI : 10.1086 / 317129 .
- ^ Schilke, P .; Ментен, К.М. (2003). "Обнаружение второй, сильной субмиллиметровой лазерной линии HCN в направлении углеродных звезд". Астрофизический журнал . 583 (1): 446–450. Полномочный код : 2003ApJ ... 583..446S . DOI : 10.1086 / 345099 .
- ^ а б Богер, Г.И.; Штернберг, А. (2005). «CN и HCN в плотных межзвездных облаках». Астрофизический журнал . 632 (1): 302–315. arXiv : astro-ph / 0506535 . Bibcode : 2005ApJ ... 632..302B . DOI : 10.1086 / 432864 . S2CID 118958200 .
- ^ Gao, Y .; Соломон, PM (2004). «Скорость звездообразования и плотный молекулярный газ в галактиках». Астрофизический журнал . 606 (1): 271–290. arXiv : astro-ph / 0310339 . Bibcode : 2004ApJ ... 606..271G . DOI : 10.1086 / 382999 . S2CID 11335358 .
- ^ Gao, Y .; Соломон, PM (2004). «Обзор HCN нормальных спиральных, инфракрасных и сверхъестественных галактик». Серия дополнений к астрофизическим журналам . 152 (1): 63–80. arXiv : astro-ph / 0310341 . Bibcode : 2004ApJS..152 ... 63G . DOI : 10.1086 / 383003 . S2CID 9135663 .
- ^ Wu, J .; Эванс, Нью-Джерси (2003). «Признаки притока в областях, образующих массивные звезды». Астрофизический журнал . 592 (2): L79 – L82. arXiv : astro-ph / 0306543 . Bibcode : 2003ApJ ... 592L..79W . DOI : 10.1086 / 377679 . S2CID 8016228 .
- ^ Loenen, А. Ф. (2007). «Молекулярные свойства (U) LIRG: CO, HCN, HNC и HCO + ». Труды симпозиума МАС . 242 : 462–466. arXiv : 0709.3423 . Bibcode : 2007IAUS..242..462L . DOI : 10.1017 / S1743921307013609 . S2CID 14398456 .
- ↑ Зубрицкий, Елизавета; Нил-Джонс, Нэнси (11 августа 2014 г.). "РЕЛИЗ 14-038 - Трехмерное исследование комет, проведенное НАСА, показывает, что химический завод работает" . НАСА . Проверено 12 августа 2014 .
- ^ Кординер, Массачусетс; и другие. (11 августа 2014 г.). «Составление карты высвобождения летучих веществ во внутренних кометах комет C / 2012 F6 (Lemmon) и C / 2012 S1 (ISON) с использованием большого миллиметрового / субмиллиметрового массива Atacama». Астрофизический журнал . 792 (1): L2. arXiv : 1408.2458 . Bibcode : 2014ApJ ... 792L ... 2C . DOI : 10.1088 / 2041-8205 / 792/1 / L2 . S2CID 26277035 .
- ^ "Первое обнаружение атмосферы суперземли" . Информационный центр ЕКА / Хаббла. 16 февраля 2016 г.
- ^ Шнедлиц, Маркус (2008) Chemische Kampfstoffe: Geschichte, Eigenschaften, Wirkung . ГРИН Верлаг. п. 13. ISBN 364023360-3 .
- ^ Оружие войны - Ядовитый газ . firstworldwar.com
- ^ a b Воздействие на окружающую среду и здоровье . Cyanidecode.org. Проверено 2 июня 2012.
- ^ "Цианистый водород" . Организация по запрещению химического оружия . Проверено 14 января 2009 .
- ^ Дворк, Д .; ван Пелт, Р.Дж. (1996). Освенцим, 1270 г. по настоящее время . Нортон. п. 443 . ISBN 978-0-393-03933-7.
- ^ "СИНИЙ ДЫМ" . Химический завод «Драсловка» . Проверено 6 июля 2020 .
- ^ "Сайт Poison Garden" . Проверено 18 октября 2014 года .
- ^ «Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH) - 74908» . NIOSH.
Внешние ссылки [ править ]
- Национальный институт исследований и безопасности (1997 год). « Cyanure d'hydrogène и др . Водные растворы ». Fichexicologique n ° 4 , Париж: INRS, 5 стр. (PDF-файл, на французском языке )
- Международная карта химической безопасности 0492
- Цианистый водород и цианиды ( CICAD 61)
- Национальный реестр загрязнителей: информационный бюллетень по цианидным соединениям
- Карманный справочник NIOSH по химической опасности
- Управление здравоохранения
- Плотность газообразного цианистого водорода
