| Nucleus accumbens | |
|---|---|
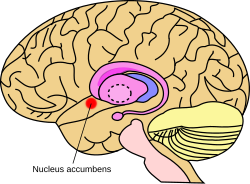 Примерное расположение прилежащего ядра в головном мозге | |
 Nucleus accumbens мозга мыши | |
| Подробности | |
| Часть | Мезолимбический путь Базальные ганглии ( брюшное полосатое тело ) |
| Запчасти | Оболочка Nucleus accumbens Ядро прилежащего ядра |
| Идентификаторы | |
| латинский | прилежащее ядро септи |
| Акроним (ы) | NAc или NAcc |
| MeSH | D009714 |
| NeuroNames | 277 |
| НейроЛекс ID | birnlex_727 |
| TA98 | A14.1.09.440 |
| TA2 | 5558 |
| FMA | 61889 |
| Анатомические термины нейроанатомии | |
Прилежащем ядре ( NAC или NACC , также известный как прилежащего ядра , или ранее как прилежащем ядре Septi , латинский для « ядра примыкает к перегородке ») представляет собой область , в базальных отделах переднего мозга ростральной к преоптическом в гипоталамусе . [1] Прилежащее ядро и обонятельный бугорок вместе образуют вентральное полосатое тело . Вентральное полосатое тело и дорсальное полосатое тело вместе образуют полосатое тело., который является основным компонентом базальных ганглиев . [2] В дофаминергических нейронах по мезолимбическому пути проекта на ГАМКергических медиальные шиповатые нейроны в прилежащем ядре и обонятельная бугорок. [3] [4] Каждое полушарие головного мозга имеет собственное прилежащее ядро, которое можно разделить на две структуры: ядро прилежащего ядра и оболочку прилежащего ядра. Эти подструктуры имеют разную морфологию и функции.
Различные субрегионы NAcc (ядро против оболочки) и субпопуляции нейронов в каждой области ( нейроны со средними шипами D1-типа и D2-типа ) ответственны за различные когнитивные функции . [5] [6] В целом прилежащее ядро играет важную роль в когнитивной обработке мотивации , отвращения , вознаграждения (т. Е. Значимости стимулов , удовольствия и положительного подкрепления ) и обучения с подкреплением (например, инструментальный перенос Павлова) ); [4] [7] [8] [9] [10]следовательно, он играет важную роль в развитии зависимости . [4] [8] Кроме того, часть ядра прилежащего ядра принимает центральное участие в индукции медленноволнового сна . [11] [12] [13] [14] Прилежащее ядро играет меньшую роль в обработке страха (форма отвращения), импульсивности и эффекта плацебо . [15] [16] [17] Он также участвует в кодировании новых моторных программ . [4]
Структура [ править ]
Прилежащее ядро - это совокупность нейронов, которая описывается как имеющая внешнюю оболочку и внутреннее ядро. [4]
Ввод [ редактировать ]
Основные глутаматергические входы в прилежащее ядро включают префронтальную кору (в частности, префронтальную кору и инфралимбическую кору ), базолатеральную миндалину , вентральный гиппокамп , таламические ядра (особенно ядра таламуса средней линии и интраламинарные ядра таламуса ) и глутаматергические выступы вентральной области. площадь (ВТА). [18] Прилежащее ядро получает дофаминергические входы из вентральной тегментальной области, которые соединяются через мезолимбический путь.. Прилежащее ядро часто описывается как часть кортико-базальных ганглиев-таламо-кортикальной петли . [19]
Дофаминергические входы от VTA модулируют активность ГАМКергических нейронов в прилежащем ядре. Эти нейроны прямо или косвенно активируются препаратами, вызывающими эйфорию (например, амфетамином , опиатами и т. Д.), И участвуя в полезном опыте (например, сексе, музыке, упражнениях и т. Д.). [20] [21]
Другой важный источник ввода происходит от СА1 и вентральной подлежащей ткани из гиппокампа в дорсомедиальном области прилежащего ядра. Незначительная деполяризация клеток в прилежащем ядре коррелирует с положительностью нейронов гиппокампа, что делает их более возбудимыми. Коррелированные клетки этих возбужденных состояний нейронов со средними шипами в прилежащем ядре в равной степени распределяются между субикулумом и CA1. Обнаружено, что нейроны субикулума гиперполяризованы (увеличивают негативность), в то время как нейроны CA1 «колеблются» (срабатывают> 50 Гц), чтобы выполнить это праймирование. [22]
Прилежащее ядро - одна из немногих областей, которые получают гистаминергические проекции из туберомаммиллярного ядра (единственного источника гистаминовых нейронов в головном мозге). [23]
Вывод [ править ]
Выходные нейроны прилежащего ядра посылают проекции аксонов в базальные ганглии и вентральный аналог бледного шара , известный как вентральный паллидум (VP). ВП, в свою очередь, проецируется на медиальное дорсальное ядро дорсального таламуса , которое проецируется в префронтальную кору, а также в полосатое тело . Другие эфференты из прилежащего ядра включают в себя соединение с хвостом вентральной области покрышки , [24] черной субстанцией , и ретикулярной формацией из моста . [1]
Shell [ править ]
Прилежащем ядре оболочки ( NACC оболочки ) является подструктура прилежащем ядре. Оболочка и ядро вместе образуют все прилежащее ядро.
Расположение: оболочка является внешней областью прилежащего ядра и, в отличие от ядра, считается частью расширенной миндалины , расположенной на ее ростральном полюсе.
Типы клеток: Нейроны в прилежащем ядре в основном медиальных шиповатых нейронов (MSNs) , содержащие , главным образом , D1-типа (то есть, DRD1 и DRD5 ) или D2-типа (то есть, DRD2 , DRD3 и DRD4 ) дофаминовые рецепторы . Субпопуляции множественных абонентских номеров содержат как D1-типа и D2-рецепторы типа, причем примерно 40% от стриатума , экспрессирующих оба множественных абонентских номеров DRD1 и DRD2 мРНК. [19] [25] [26] Эти MSN NAcc смешанного типа с рецепторами D1-типа и D2 в основном ограничены оболочкой NAcc. [19]Нейроны в оболочке, по сравнению с ядром, имеют более низкую плотность дендритных шипов , меньше конечных сегментов и меньше сегментов ветвей, чем в ядре. Оболочечные нейроны проецируются в субкомиссуральную часть вентрального паллидума, а также в вентральную тегментальную область и в обширные области в гипоталамусе и расширенной миндалине. [27] [28] [29]
Функция: оболочка прилежащего ядра участвует в когнитивной обработке вознаграждения , включая субъективные реакции «симпатии» на определенные приятные стимулы , мотивационную значимость и положительное подкрепление . [4] [5] [30] [31] Также было показано, что эта оболочка NAcc опосредует специфический Павлово-инструментальный перенос , феномен, при котором классически обусловленный стимул изменяет оперантное поведение . [32] [9] [10]«Гедонистическая точка» или центр удовольствия, который отвечает за компонент удовольствия или «симпатии» некоторых внутренних наград, также расположен в небольшом отсеке внутри медиальной оболочки NAcc. [30] [33] [34] Лекарства, вызывающие привыкание, сильнее влияют на высвобождение дофамина в оболочке, чем в ядре. [4]
Ядро [ править ]
Прилежащее ядро ядра ( ядро NACC ) является внутренней подструктурой прилежащего ядра.
Расположение: ядро прилежащего ядра является частью вентрального полосатого тела , расположенного внутри базальных ганглиев. Типы клеток: ядро NAcc состоит в основном из нейронов со средними шипами, содержащими в основном дофаминовые рецепторы D1-типа или D2-типа. Средние шиповатые нейроны D1-типа опосредуют когнитивные процессы, связанные с вознаграждением [5] [35] [36], тогда как средние шиповатые нейроны D2-типа опосредуют когнитивные способности, связанные с отвращением. [6] Нейроны в ядре, по сравнению с нейронами в оболочке, имеют повышенную плотность дендритных шипов, сегментов ветвей и терминальных сегментов. Из ядра нейроны проецируются на другие подкорковые области, такие как бледный шар и черная субстанция. ГАМКявляется одним из основных нейротрансмиттеров в NAcc, и рецепторы ГАМК также многочисленны. [27] [29]
Функция: ядро прилежащего ядра участвует в когнитивной обработке двигательной функции, связанной с вознаграждением и подкреплением, а также в регулировании медленноволнового сна . [4] [11] [12] [13] В частности, ядро кодирует новые двигательные программы, которые облегчают получение заданного вознаграждения в будущем. [4] Нейроны непрямого пути (например, D2-типа) в ядре NAcc, ко-экспрессирующие аденозиновые рецепторы A 2A, зависимо от активации, способствуют медленноволновому сну. [11] [12] [13] Также было показано, что ядро NAcc обеспечивает общий павловско-инструментальный перенос, феномен, при котором классически обусловленный раздражитель изменяет оперантное поведение. [32] [9] [10]
Типы ячеек [ править ]
Приблизительно 95% нейронов в NAcc являются ГАМКергическими нейронами со средним шипом (MSN), которые в основном экспрессируют рецепторы D1-типа или D2-типа; [20] около 1–2% остальных типов нейронов представляют собой большие аспин- холинергические интернейроны, а еще 1-2% - ГАМКергические интернейроны. [20] По сравнению с GABAergic MSN в оболочке, MSN в ядре имеют повышенную плотность дендритных шипов, сегментов ветвей и конечных сегментов. Из ядра нейроны проецируются на другие подкорковые области, такие как бледный шар и черная субстанция. ГАМК - один из основных нейромедиаторов в NAcc, и рецепторы ГАМК также широко распространены. [27] [29] Эти нейроны также являются главными проекционными или выходными нейронами прилежащего ядра.
Нейрохимия [ править ]
Некоторые из нейротрансмиттеров, нейромодуляторов и гормонов, которые передают сигнал через рецепторы в прилежащем ядре, включают:
Дофамин : дофамин высвобождается в прилежащее ядро после воздействия положительных стимулов , включая рекреационные наркотики, такие как замещенные амфетамины , кокаин , никотин и морфин . [37] [38]
Фенэтиламин и тирамин : фенэтиламин и тирамин - это следовые амины, которые синтезируются в нейронах, которые экспрессируют фермент гидроксилазу ароматических аминокислот (AADC), который включает все дофаминергические нейроны. [39] Оба соединения действуют как дофаминергические нейромодуляторы, которые регулируют обратный захват и высвобождение дофамина в Nacc посредством взаимодействий с VMAT2 и TAAR1 в конце аксона мезолимбических дофаминовых нейронов.
Глюкокортикоиды и дофамин: рецепторы глюкокортикоидов - единственные рецепторы кортикостероидов в оболочке прилежащего ядра. L-ДОФА , стероиды и особенно глюкокортикоиды в настоящее время известны как единственные известные эндогенные соединения, которые могут вызывать психотические проблемы, поэтому понимание гормонального контроля над дофаминергическими проекциями в отношении рецепторов глюкокортикоидов может привести к новым методам лечения психотических симптомов. Недавнее исследование показало, что подавление глюкокортикоидных рецепторов привело к уменьшению высвобождения дофамина, что может привести к будущим исследованиям с участием антиглюкокортикоидных препаратов для потенциального облегчения психотических симптомов. [40]
ГАМК: недавнее исследование на крысах, которые использовали агонисты и антагонисты ГАМК, показало, что рецепторы ГАМК A в оболочке NAcc имеют ингибирующий контроль над поворотным поведением, на которое влияет дофамин, а рецепторы ГАМК B имеют ингибирующий контроль над поворотным поведением, опосредованным ацетилхолином . [27] [41]
Глутамат : исследования показали, что локальная блокада глутаматергических рецепторов NMDA в ядре NAcc нарушает пространственное обучение. [42] Другое исследование продемонстрировало, что и NMDA, и AMPA (оба рецептора глутамата ) играют важную роль в регулировании инструментального обучения. [43]
Серотонин (5-HT): в целом, 5-HT синапсов более многочисленны и имеют большее количество синаптических контактов в оболочке NAcc, чем в ядре. Они также больше и толще и содержат более крупные плотные сердцевинные везикулы, чем их аналоги в сердцевине.
Функция [ править ]
Награда и поощрение [ править ]
Прилежащее ядро, являясь одной из частей системы вознаграждения, играет важную роль в обработке стимулирующих стимулов, подкрепляющих стимулов (например, еда и вода), а также тех, которые являются одновременно поощрительными и подкрепляющими (вызывающие привыкание наркотики, секс и упражнения). [4] [44] Преобладающим ответом нейронов прилежащего ядра на вознаграждение сахарозой является ингибирование; обратное верно при приеме аверсивного хинина . [45] Существенные данные фармакологических манипуляций также предполагают, что снижение возбудимости нейронов в прилежащем ядре является полезным, как, например, было бы верно в случае стимуляции µ-опиоидных рецепторов . [46]Зависимый от уровня кислорода в крови сигнал (ЖИРНЫЙ) в прилежащем ядре избирательно усиливается во время восприятия приятных, эмоционально возбуждающих картинок и во время мысленных образов приятных эмоциональных сцен. Однако, поскольку BOLD считается косвенной мерой регионального сетевого возбуждения к ингибированию, степень, в которой BOLD измеряет процессинг, зависящий от валентности, неизвестен. [47] [48] Из-за большого количества входов NAcc из лимбических областей и сильных выходов NAcc в моторные регионы, прилежащее ядро было описано Гордоном Могенсеном как интерфейс между лимбической и моторной системами. [49] [50]
Прилежащее ядро причинно связано с переживанием удовольствия. Микроинъекции μ-опиоидных агонистов, δ-опиоидных агонистов или κ-опиоидных агонистов в ростродорсальный квадрант медиальной оболочки усиливают «симпатию», тогда как более каудальные инъекции могут подавлять реакции отвращения, симпатии или и то, и другое. [30] Области прилежащего ядра, которым можно приписать причинную роль в производстве удовольствия, ограничены как анатомически, так и химически, поскольку помимо опиоидных агонистов только эндоканнабиноиды могут усиливать симпатию. В прилежащем ядре в целом присутствует дофамин, агонист рецептора ГАМК или антагонисты AMPAизменить только мотивацию, в то время как то же самое верно для опиоидов и эндоканнабиноидов за пределами горячей точки в медиальной оболочке. Ростро-каудальный градиент существует для усиления аппетитных реакций по сравнению со страхом, последний из которых традиционно считается требующим только функции рецептора D1, а первый из которых требует функции как D1, так и D2. Одна интерпретация этого открытия, гипотеза растормаживания, постулирует, что ингибирование прилежащих MSN (которые являются ГАМКергическими) растормаживает нижележащие структуры, делая возможным проявление аппетитного или консумативного поведения. [52] Мотивационные эффекты антагонистов AMPA и, в меньшей степени, агонистов GABA, анатомически гибки. Стрессовые условия могут расширить области, вызывающие страх, в то время как знакомая среда может уменьшить размер области, вызывающей страх. Более того, кортикальный вход из орбитофронтальной коры (OFC) смещает реакцию в сторону аппетитного поведения, а инфралимбический вход, эквивалентный субгенуальной поясной коры человека, подавляет реакцию независимо от валентности. [30]
Прилежащее ядро не является ни необходимым, ни достаточным для инструментального обучения, хотя манипуляции могут повлиять на выполнение задач инструментального обучения. Одна из задач, в которой эффект поражения NAcc очевиден, - это Павлово-инструментальный перенос (PIT), где сигнал в сочетании с конкретным или общим вознаграждением может усилить инструментальную реакцию. Поражения ядра NAcc ухудшают производительность после девальвации и подавляют эффект общего PIT. С другой стороны, повреждения оболочки только ухудшают эффект специфического PIT. Считается, что это различие отражает согласованные и аппетитные условные реакции в оболочке NAcc и ядре NAcc, соответственно. [53]
В дорсальном полосатом теле наблюдается дихотомия между D1-MSN и D2-MSN, при этом первые усиливают и усиливают локомоцию, а вторые - отталкивающие и уменьшающие локомоцию. Традиционно считалось, что такое различие применимо и к прилежащему ядру, но данные фармакологических и оптогенетических исследований противоречивы. Более того, подмножество NAcc MSN экспрессируют как D1, так и D2 MSN, и фармакологическая активация D1 по сравнению с рецепторами D2 не обязательно должна точно активировать нервные популяции. В то время как большинство исследований не показывают влияния селективной оптогенетической стимуляции D1 или D2 MSN на двигательную активность, в одном исследовании сообщалось об уменьшении базальной локомоции при стимуляции D2-MSN. Хотя в двух исследованиях сообщалось о снижении усиливающих эффектов кокаина при активации D2-MSN,одно исследование не сообщило об отсутствии эффекта. Сообщалось также, что активация NAcc D2-MSN усиливает мотивацию, по оценке PIT, а активность рецептора D2 необходима для усиливающих эффектов стимуляции VTA.[54] В исследовании 2018 года сообщается, что активация D2 MSN усиливает мотивацию за счет ингибирования вентрального бледного движения, тем самым подавляя VTA. [55]
Материнское поведение [ править ]
Исследование с помощью фМРТ, проведенное в 2005 году, показало, что, когда крысы-матери находились в присутствии своих детенышей, области мозга, участвующие в подкреплении, включая прилежащее ядро, были очень активными. [56] Уровень дофамина увеличивается в прилежащем ядре во время поведения матери, в то время как поражения в этой области нарушают поведение матери. [57] Когда женщинам показывают фотографии неродственных младенцев, фМРТ показывают повышенную активность мозга в прилежащем ядре и прилежащем хвостатом ядре, пропорционально тому, насколько женщины находят этих младенцев «милыми». [58]
Отвращение [ править ]
Активация MSN типа D1 в прилежащем ядре участвует в вознаграждении, тогда как активация MSN типа D2 в прилежащем ядре способствует отвращению . [6]
Медленноволновой сон [ править ]
В конце 2017 года исследования на грызунах с использованием оптогенетических и хемогенетических методов показали, что шиповатые нейроны непрямого пути (т. Е. D2-типа) в ядре прилежащего ядра, коэкспрессирующие аденозиновые рецепторы A 2A и проецирующиеся в вентральный паллидум , участвуют в регуляция медленноволнового сна . [11] [12] [13] [14] В частности, оптогенетическая активация этих нейронов ядра NAcc косвенного пути вызывает медленный сон, а хемогенетическая активация тех же нейронов увеличивает количество и продолжительность эпизодов медленноволнового сна. [12] [13] [14]Хемогенетическое ингибирование этих нейронов ядра NAcc подавляет сон. [12] [13] Напротив, нейроны со средними шипами D2-типа в оболочке NAcc, которые экспрессируют аденозиновые рецепторы A 2A , не играют никакой роли в регуляции медленноволнового сна. [12] [13]
Клиническое значение [ править ]
Зависимость [ править ]
Современные модели зависимости от хронического употребления наркотиков включают изменения в экспрессии генов в мезокортиколимбической проекции . [20] [59] [60] Наиболее важными факторами транскрипции , вызывающими эти изменения, являются ΔFosB , белок, связывающий элемент ответа на циклический аденозинмонофосфат ( цАМФ ) ( CREB ), и ядерный фактор каппа B ( NFκB ). [20] ΔFosB является наиболее значимым фактором транскрипции гена при зависимости, поскольку его вирусная или генетическая сверхэкспрессия в прилежащем ядре необходима и достаточна.для многих из нейронных адаптаций и поведенческих эффектов (например, зависимое от экспрессии увеличение самоуправления и поощрение сенсибилизации ), наблюдаемых при наркомании. [20] [35] [61] Сверхэкспрессия ΔFosB была связана, в частности, с зависимостью от алкоголя (этанола) , каннабиноидов , кокаина , метилфенидата , никотина , опиоидов , фенциклидина , пропофола и замещенных амфетаминов . [20] [59] [61] [62] [63]Повышение экспрессии ΔJunD прилежащего ядра может снижать или, при значительном увеличении, даже блокировать большинство нейронных изменений, наблюдаемых при хроническом злоупотреблении наркотиками (т.е. изменения, опосредованные ΔFosB). [20]
ΔFosB также играет важную роль в регулировании поведенческих реакций на естественные награды, такие как вкусная еда, секс и упражнения. [20] [21] Естественные вознаграждения, такие как наркотики, вызывающие злоупотребление, вызывают ΔFosB в прилежащем ядре, и хроническое получение этих вознаграждений может привести к аналогичному патологическому состоянию зависимости из-за сверхэкспрессии ΔFosB. [20] [21] [44] Следовательно, ΔFosB также является ключевым фактором транскрипции, участвующим в пристрастиях к естественным вознаграждениям; [20] [21] [44] в частности, ΔFosB в прилежащем ядре имеет решающее значение для усиливающих эффектов сексуального вознаграждения. [21]Исследования взаимодействия между естественными и лекарственными вознаграждениями показывают, что психостимуляторы и сексуальное поведение действуют на аналогичные биомолекулярные механизмы, индуцируя ΔFosB в прилежащем ядре, и обладают эффектами перекрестной сенсибилизации, которые опосредуются через ΔFosB. [44] [64]
Как и в случае с лекарственными препаратами, немедикаментозные поощрения также увеличивают уровень внеклеточного дофамина в оболочке NAcc. Вызванное лекарством высвобождение дофамина в оболочке NAcc и ядре NAcc обычно не склонно к привыканию (т. Е. Развитию лекарственной толерантности : уменьшение высвобождения дофамина от будущего воздействия лекарственного средства в результате повторного воздействия лекарственного средства); Напротив, повторное воздействие лекарств, которые вызывают высвобождение дофамина в оболочке и ядре NAcc, обычно приводит к сенсибилизации (т. е. количество дофамина, которое высвобождается в NAcc от будущего воздействия лекарственного средства, увеличивается в результате повторного воздействия лекарственного средства). Сенсибилизация высвобождения дофамина в оболочке NAcc после многократного воздействия лекарств служит для усиления ассоциаций стимул-лекарство (т. Е.классическое обусловливание, которое возникает, когда употребление наркотиков неоднократно сочетается со стимулами окружающей среды), и эти ассоциации становятся менее склонными к исчезновению (то есть «отучить» эти классически обусловленные ассоциации между употреблением наркотиков и стимулами окружающей среды становится более трудным). После многократного спаривания эти классически обусловленные стимулы окружающей среды (например, контексты и объекты, которые часто сочетаются с употреблением наркотиков) часто становятся сигналами к наркотикам, которые действуют как вторичные подкрепляющие факторы употребления наркотиков (т. вызывает тягу или желание употреблять наркотик, с которым они стали ассоциироваться ). [27] [38]
В отличие от лекарств, высвобождение дофамина в оболочке NAcc многими типами полезных немедикаментозных стимулов обычно вызывает привыкание после многократного воздействия (т. Е. Количество дофамина, которое высвобождается в результате будущего воздействия полезного немедикаментозного стимула, обычно уменьшается. в результате многократного воздействия этого стимула). [27] [38]
| Форма нейропластичности или поведенческой пластичности | Тип подкрепления | Источники | |||||
|---|---|---|---|---|---|---|---|
| Опиаты | Психостимуляторы | Пища с высоким содержанием жира или сахара | Половой акт | Физические упражнения (аэробика) | Обогащение окружающей среды | ||
| Экспрессия ΔFosB в MSN D1-типа прилежащего ядра | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [44] |
| Поведенческая пластичность | |||||||
| Эскалация приема | да | да | да | [44] | |||
| Перекрестная сенсибилизация с помощью психостимуляторов | да | Непригодный | да | да | Ослабленный | Ослабленный | [44] |
| Самостоятельное введение психостимуляторов | ↑ | ↑ | ↓ | ↓ | ↓ | [44] | |
| Психостимулятор с условным предпочтением места | ↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [44] |
| Восстановление поведения, связанного с поиском наркотиков | ↑ | ↑ | ↓ | ↓ | [44] | ||
| Нейрохимическая пластичность | |||||||
| Фосфорилирование CREB в прилежащем ядре | ↓ | ↓ | ↓ | ↓ | ↓ | [44] | |
| Сенсибилизированный дофаминовый ответ в прилежащем ядре | Нет | да | Нет | да | [44] | ||
| Измененная передача сигналов дофамина в полосатом теле | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | [44] | |
| Измененная передача сигналов опиоидов в полосатом теле | Без изменений или ↑ μ-опиоидных рецепторов | ↑ μ-опиоидные рецепторы ↑ κ-опиоидные рецепторы | ↑ μ-опиоидные рецепторы | ↑ μ-опиоидные рецепторы | Без изменений | Без изменений | [44] |
| Изменения опиоидных пептидов полосатого тела | ↑ динорфин Без изменений: энкефалин | ↑ динорфин | ↓ энкефалин | ↑ динорфин | ↑ динорфин | [44] | |
| Мезокортиколимбическая синаптическая пластичность | |||||||
| Количество дендритов в прилежащем ядре | ↓ | ↑ | ↑ | [44] | |||
| Дендритный позвоночник плотность в прилежащем ядре | ↓ | ↑ | ↑ | [44] | |||
Депрессия [ править ]
В апреле 2007 года две исследовательские группы сообщили, что в прилежащее ядро вставили электроды, чтобы использовать глубокую стимуляцию мозга для лечения тяжелой депрессии . [65] В 2010 году эксперименты показали, что глубокая стимуляция прилежащего ядра мозга позволила уменьшить симптомы депрессии у 50% пациентов, которые не ответили на другие виды лечения, такие как электросудорожная терапия . [66] Nucleus accumbens также использовался в качестве мишени для лечения небольших групп пациентов с рефрактерным к терапии обсессивно-компульсивным расстройством. [67]
Абляция [ править ]
Для лечения зависимости и в попытке вылечить психическое заболевание была проведена радиочастотная абляция прилежащего ядра. Результаты неубедительны и противоречивы. [68] [69]
Эффект плацебо [ править ]
Было показано, что активация NAcc происходит в ожидании эффективности лекарства, когда пользователю дают плацебо , что указывает на роль прилежащего ядра в эффекте плацебо . [16] [70]
Дополнительные изображения [ править ]
Дофамин и серотонин
Коронарный срез МРТ, показывающий прилежащее ядро, обведенное красным
Сагиттальный срез МРТ с выделением (красным) прилежащего ядра.
См. Также [ править ]
- Ядра перегородки
Ссылки [ править ]
- ^ а б Карлсон Н.Р. (2013). Физиология поведения (11-е изд.). Бостон: Пирсон.[ требуется страница ]
- ^ Прилежащее ядро
- ^ Икемото S (ноябрь 2010). «Схема вознаграждения мозга за пределами мезолимбической дофаминовой системы: нейробиологическая теория» . Неврология и биоповеденческие обзоры . 35 (2): 129–50. DOI : 10.1016 / j.neubiorev.2010.02.001 . PMC 2894302 . PMID 20149820 .
Недавние исследования внутричерепного самостоятельного введения нейрохимических веществ (лекарств) показали, что крысы учатся самостоятельно вводить различные препараты в мезолимбические структуры дофамина - заднюю вентральную тегментальную область, прилежащее ядро медиальной оболочки и медиальный обонятельный бугорок. ... В 1970-х годах было признано, что обонятельный бугорок содержит стриарный компонент, который заполнен ГАМКергическими средними шиповидными нейронами, получающими глутаматергические входные сигналы из кортикальных областей и дофаминергические входные сигналы от ВТА и проецирующиеся в вентральный паллидум так же, как прилежащее ядро.
Рисунок 3: Вентральное полосатое тело и самостоятельное введение амфетамина - ^ a b c d e f g h i j Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: Фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. стр. 147–148, 367, 376. ISBN 978-0-07-148127-4.
Нейроны VTA DA играют решающую роль в мотивации, поведении, связанном с вознаграждением (глава 15), внимании и множественных формах памяти. Такая организация DA-системы, широкая проекция из ограниченного числа клеточных тел, позволяет скоординированно реагировать на новые мощные награды. Таким образом, действуя в различных конечных областях, дофамин придает мотивационную значимость («желание») самой награде или связанным с ней сигналам (область оболочки прилежащего ядра), обновляет значение, придаваемое различным целям, в свете этого нового опыта (орбитальная префронтальная кора), помогает консолидировать несколько форм памяти (миндалевидное тело и гиппокамп) и кодирует новые моторные программы, которые облегчат получение этой награды в будущем (область ядра прилежащего ядра и дорсальное полосатое тело). В этом примередофамин модулирует обработку сенсомоторной информации в различных нервных цепях, чтобы максимизировать способность организма получать будущие вознаграждения. ...
Схема вознаграждения мозга, на которую нацелены наркотики, вызывающие привыкание, обычно опосредует получение удовольствия и укрепление поведения, связанного с естественными подкреплениями, такими как еда, вода и сексуальный контакт. Дофаминовые нейроны в VTA активируются пищей и водой, а высвобождение дофамина в NAc стимулируется присутствием естественных подкрепляющих веществ, таких как еда, вода или половой партнер. ...
NAc и VTA являются центральными компонентами схемы, лежащей в основе вознаграждения и памяти о вознаграждении. Как упоминалось ранее, активность дофаминергических нейронов в VTA, по-видимому, связана с предсказанием вознаграждения. NAc участвует в обучении, связанном с подкреплением и модуляцией моторных ответов на стимулы, которые удовлетворяют внутренние гомеостатические потребности. Оболочка NAc, по-видимому, особенно важна для начальных действий лекарства в рамках схемы вознаграждения; наркотики, вызывающие привыкание, оказывают большее влияние на высвобождение дофамина в оболочке, чем в ядре NAc. - ^ a b c Саддорис MP, Cacciapaglia F, Wightman RM, Carelli RM (август 2015 г.). «Дифференциальная динамика высвобождения дофамина в ядре Accumbens ядра и оболочке выявляет дополнительные сигналы для прогнозирования ошибок и мотивации» . Журнал неврологии . 35 (33): 11572–82. DOI : 10.1523 / JNEUROSCI.2344-15.2015 . PMC 4540796 . PMID 26290234 .
Здесь мы обнаружили, что высвобождение дофамина в прилежащем ядре (первичная мишень дофаминовых нейронов среднего мозга) в реальном времени сильно различается между субрегионами ядра и оболочки. В основном, динамика дофамина согласуется с теориями, основанными на обучении (такими как ошибка предсказания вознаграждения), тогда как в оболочке дофамин согласуется с теориями, основанными на мотивации (например, значимостью стимулов).
- ^ а б в Калипари Е.С., Багот Р.С., Пурушотаман I, Дэвидсон Т.Дж., Йоргасон Дж.Т., Пенья С.Дж., Уокер Д.М., Пирпиниас С.Т., Гиз К.Г., Рамакришнан С., Дейссерот К., Нестлер Э.Д. (март 2016 г.). «Визуализация in vivo идентифицирует временную сигнатуру шиповидных нейронов D1 и D2 в кокаиновой награде» . Труды Национальной академии наук Соединенных Штатов Америки . 113 (10): 2726–31. Bibcode : 2016PNAS..113.2726C . DOI : 10.1073 / pnas.1521238113 . PMC 4791010 . PMID 26831103 .
Повышенная активность мезолимбической дофаминовой системы является центральным механизмом, лежащим в основе подкрепляющих и вознаграждающих действий злоупотребляемых наркотиков, включая кокаин, а также компульсивного поиска наркотиков, который развивается с течением времени и характеризует состояние зависимости (10–12). Действие дофамина в NAc опосредуется преимущественно через активацию дофаминовых рецепторов D1 или D2, которые экспрессируются в основном неперекрывающимися популяциями нейронов со средними шипами (MSN) (13). Эти два подтипа MSN оказывают противоположное влияние на поведение, при этом оптогенетическая активация нейронов D1-типа способствует положительному подкреплению и увеличивает образование ассоциаций кокаинового вознаграждения и контекста, а активация нейронов D2-типа вызывает отвращение и снижает вознаграждение кокаином (14, 15). ; связанные различия в поведенческих реакциях видны в ответ на D1 vs.Агонисты или антагонисты рецептора D2 (16). ... Предыдущая работа продемонстрировала, что оптогенетическая стимуляция D1 MSN способствует вознаграждению, тогда как стимуляция D2 MSN вызывает отвращение.
- ^ Венцель JM, Рошер Н.А., Cheer JF, Oleson EB (январь 2015). «Роль фазового высвобождения дофамина в прилежащем ядре в кодировании отвращения: обзор нейрохимической литературы» . ACS Chemical Neuroscience . 6 (1): 16–26. DOI : 10.1021 / cn500255p . PMC 5820768 . PMID 25491156 .
Таким образом, стимулы, вызывающие страх, способны по-разному изменять фазовую передачу дофамина в субрегионах NAcc. Авторы предполагают, что наблюдаемое усиление дофамина оболочки NAcc, вероятно, отражает общую мотивационную значимость, возможно, из-за облегчения состояния страха, вызванного CS, когда УЗ (удар ногой) не применяется. Это рассуждение подтверждается отчетом Будыгина и его коллег 112, показывающим, что у анестезированных крыс прекращение защемления хвоста приводит к увеличению высвобождения дофамина в скорлупе.
- ^ a b Malenka RC, Nestler EJ, Hyman SE (2009). «Глава 10: Нейронный и нейроэндокринный контроль внутренней среды». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: Фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. п. 266. ISBN. 978-0-07-148127-4.
Дофамин действует в прилежащем ядре, придавая мотивационное значение стимулам, связанным с вознаграждением.
- ^ a b c Salamone JD, Pardo M, Yohn SE, López-Cruz L, SanMiguel N, Correa M (2016). «Мезолимбический допамин и регуляция мотивированного поведения». Актуальные темы поведенческой нейронауки . 27 : 231–57. DOI : 10.1007 / 7854_2015_383 . ISBN 978-3-319-26933-7. PMID 26323245 .
Значительные доказательства указывают на то, что accumbens DA важен для павловского подхода и передачи от Павлова к инструментам [(PIT)] ... PIT - это поведенческий процесс, который отражает влияние стимулов, обусловленных Павловым (CS), на инструментальную реакцию. Например, демонстрация Павловской CS в паре с едой может повысить результативность инструментального поведения, подкрепленного едой, такого как нажатие на рычаг. PIT, зависящий от результата, возникает, когда Павловский безусловный стимул (US) и инструментальное подкрепление являются одним и тем же стимулом, в то время как общий PIT, как говорят, возникает, когда Павловский US и подкрепление различны. ... Более свежие данные показывают, что ядро и оболочка прилегающих к телу, по-видимому, опосредуют различные аспекты PIT; повреждения скорлупы и инактивация снижают специфичный для исхода PIT,в то время как повреждения ядра и инактивация подавляли общий PIT (Corbit and Balleine 2011). Эти различия между ядром и раковиной, вероятно, связаны с разными анатомическими входами и паллидальными выходами, связанными с этими прилежащими подобластями (Root et al. 2015). Эти результаты привели Corbit and Balleine (2011) к предположению, что accumbens core опосредует общие возбуждающие эффекты сигналов, связанных с вознаграждением. PIT обеспечивает фундаментальный поведенческий процесс, посредством которого условные стимулы могут оказывать активирующее действие на инструментальную реакциюЭти результаты привели Corbit and Balleine (2011) к предположению, что accumbens core опосредует общие возбуждающие эффекты сигналов, связанных с вознаграждением. PIT обеспечивает фундаментальный поведенческий процесс, посредством которого условные стимулы могут оказывать активирующее действие на инструментальную реакциюЭти результаты привели Corbit and Balleine (2011) к предположению, что accumbens core опосредует общие возбуждающие эффекты сигналов, связанных с вознаграждением. PIT обеспечивает фундаментальный поведенческий процесс, посредством которого условные стимулы могут оказывать активирующее действие на инструментальную реакцию
- ^ a b c Корбит Л. Х., Баллейн Б. В. (2016). «Процессы обучения и мотивации, способствующие передаче инструментальных средств Павлова и их нейронные основы: дофамин и не только». Актуальные темы поведенческой нейронауки . 27 : 259–89. DOI : 10.1007 / 7854_2015_388 . ISBN 978-3-319-26933-7. PMID 26695169 .
Такие эффекты предполагают, что определенные мотивационные состояния ограничивают возбуждающие эффекты процессов стимулирования Павлова на инструментальную производительность ... Поведенческие данные подтверждаются доказательствами того, что отдельные нейронные цепи, сосредоточенные на ядре и оболочке NAc, опосредуют общие и специфические формы передачи, соответственно, и Текущая работа начинает объяснять, как павловские и инструментальные процессы обучения, которые происходят независимо и в разное время, интегрируются в нейронные цепи, управляющие поведенческим контролем.
- ^ a b c d Cherasse Y, Urade Y (ноябрь 2017 г.). «Диетический цинк действует как модулятор сна» . Международный журнал молекулярных наук . 18 (11): 2334. DOI : 10,3390 / ijms18112334 . PMC 5713303 . PMID 29113075 .
Совсем недавно лаборатория Фуллера также обнаружила, что сну может способствовать активация гамма-аминомасляной кислоты-эргической (ГАМКергической) популяции нейронов, расположенных в парафациальной зоне [11,12], в то время как роль нейронов, экспрессирующих ГАМКергический A2AR, прилежащего ядра [13] и полосатого тела только что обнаружено [14,15].
- ^ a b c d e f g Валенсия Гарсия S, Форт P (февраль 2018 г.). «Nucleus Accumbens, новая область регулирования сна за счет интеграции мотивационных стимулов» . Acta Pharmacologica Sinica . 39 (2): 165–166. DOI : 10.1038 / aps.2017.168 . PMC 5800466 . PMID 29283174 .
Прилежащее ядро включает контингент нейронов, специфически экспрессирующих подтип постсинаптических рецепторов A2A (A2AR), делающих их возбудимыми аденозином, его естественным агонистом, наделенным мощными способствующими засыпанию свойствами [4]. ... В обоих случаях большая активация нейронов, экспрессирующих A2AR в NAc, способствует медленноволновому сну (SWS) за счет увеличения количества и продолжительности эпизодов. ... После оптогенетической активации ядра наблюдали аналогичное продвижение SWS, тогда как при активации A2AR-экспрессирующих нейронов внутри оболочки не было индуцировано значительных эффектов.
- ^ Б с д е е г Оиси Y, Q Сю, Ван L, Zhang BJ, Takahashi K, Y, Takata Ло YJ, Cherasse Y, Schiffmann С.Н., де Кершов d'Exaerde A, Y, Urade Qu WM, Huang ZL , Lazarus M (сентябрь 2017 г.). «Медленноволновой сон у мышей контролируется подмножеством основных нейронов прилежащего ядра» . Nature Communications . 8 (1): 734. Bibcode : 2017NatCo ... 8..734O . DOI : 10.1038 / s41467-017-00781-4 . PMC 5622037 . PMID 28963505 .
Здесь мы показываем, что хемогенетическая или оптогенетическая активация возбуждающих нейронов непрямого пути, экспрессирующих аденозиновый рецептор A2A, в центральной области NAc сильно индуцирует медленный сон. Хемогенетическое ингибирование нейронов непрямого пути NAc предотвращает индукцию сна, но не влияет на гомеостатический откат сна.
- ^ a b c Юань XS, Ван Л., Донг Х., Цюй WM, Ян С.Р., Черасс Y, Лазарус М., Шиффманн С.Н., д'Эксарде АК, Ли RX, Хуанг З.Л. (октябрь 2017 г.). «Нейроны рецептора 2А контролируют сон активного периода через нейроны парвальбумина в наружном бледном глобусе» . eLife . 6 : e29055. DOI : 10.7554 / eLife.29055 . PMC 5655138 . PMID 29022877 .
- ^ Schwienbacher I, Fendt M, Ричардсон R, Шницлер HU (ноябрь 2004). «Временная инактивация прилежащего ядра нарушает приобретение и выражение испуга, вызванного страхом, у крыс». Исследование мозга . 1027 (1–2): 87–93. DOI : 10.1016 / j.brainres.2004.08.037 . PMID 15494160 .
- ^ a b Zubieta JK, Stohler CS (март 2009 г.). «Нейробиологические механизмы реакции на плацебо» . Летопись Нью-Йоркской академии наук . 1156 (1): 198–210. Bibcode : 2009NYASA1156..198Z . DOI : 10.1111 / j.1749-6632.2009.04424.x . PMC 3073412 . PMID 19338509 .
- ^ Басар К, Сезии Т, Груневеген Н, Steinbusch HW, Висер-Vandewalle В, Темел У (декабрь 2010 г.). «Прилежащее ядро и импульсивность». Прогресс нейробиологии . 92 (4): 533–57. DOI : 10.1016 / j.pneurobio.2010.08.007 . PMID 20831892 .
- ^ Гипсон CD, Купчик YM, Kalivas PW (январь 2014). «Быстрая, преходящая синаптическая пластичность при зависимости» . Нейрофармакология . 76 Pt B: 276–86. DOI : 10.1016 / j.neuropharm.2013.04.032 . PMC 3762905 . PMID 23639436 .
В упрощенной схеме PFC-NAc-VTA NAc служит «шлюзом», через который информация о направлении поведенческого выхода обрабатывается от лимбической коры к моторным подсхемам. Считается, что переход к навязчивому поиску наркотиков происходит из-за нарушенной способности этой подсистемы эффективно обрабатывать информацию о негативных непредвиденных обстоятельствах окружающей среды, что приводит к неспособности подавлять доминантные реакции, связанные с наркотиками; тем самым наркоман становится склонным к рецидиву.
Рисунок 1: Глутаматергические афференты к прилежащему ядру, участвующие в аддиктивном поведении - ^ a b c Ягер Л. М., Гарсия А. Ф., Вунш А. М., Фергюсон С. М. (август 2015 г.). «Все подробности о полосатом теле: роль в наркомании» . Неврология . 301 : 529–541. DOI : 10.1016 / j.neuroscience.2015.06.033 . PMC 4523218 . PMID 26116518 .
[Стриатум] получает дофаминергические входы из вентральной тегментальной области (VTA) и черной субстанции (SNr), а глутаматергические входы из нескольких областей, включая кору, гиппокамп, миндалевидное тело и таламус (Swanson, 1982; Phillipson and Griffiths, 1985; Finch, 1996; Groenewegen et al., 1999; Britt et al., 2012). Эти глутаматергические входы соприкасаются с головками дендритных шипов полосатых ГАМКергических нейронов проекции шипов (MSN), тогда как дофаминергические входные синапсы на шейке позвоночника, обеспечивая важное и сложное взаимодействие между этими двумя входами в модуляции активности MSN ... Следует также отметить, что существует небольшая популяция нейронов в NAc, которые коэкспрессируют рецепторы D1 и D2, хотя это в значительной степени ограничено оболочкой NAc (Bertran-Gonzalez et al., 2008). ...Нейроны в отделах ядра NAc и оболочки NAc также различаются функционально. Ядро NAc участвует в обработке условных стимулов, тогда как оболочка NAc более важна в обработке безусловных стимулов; Традиционно считается, что эти две популяции полосатого тела MSN оказывают противоположное влияние на продукцию базальных ганглиев. Активация dMSN вызывает общее возбуждение таламуса, приводящее к положительной петле корковой обратной связи; тем самым действуя как сигнал «идти» к началу поведения. Однако активация iMSN вызывает чистое ингибирование таламической активности, что приводит к отрицательной петле корковой обратной связи и, следовательно, служит «тормозом» для подавления поведения ... также появляется все больше свидетельств того, что iMSN играют роль в мотивации и зависимости ( Lobo, Nestler, 2011; Grueter et al., 2013). ...Вместе эти данные предполагают, что iMSN обычно действуют, чтобы сдерживать поведение, связанное с приемом наркотиков, и рекрутирование этих нейронов может фактически защищать от развития компульсивного употребления наркотиков.
- ^ a b c d e f g h i j k Робисон AJ, Nestler EJ (октябрь 2011 г.). «Транскрипционные и эпигенетические механизмы зависимости» . Обзоры природы. Неврология . 12 (11): 623–37. DOI : 10.1038 / nrn3111 . PMC 3272277 . PMID 21989194 .
ΔFosB был напрямую связан с несколькими зависимостями поведения ... Важно отметить, что генетическая или вирусная сверхэкспрессия ΔJunD, доминантно-отрицательного мутанта JunD, который противодействует ΔFosB- и другой AP-1-опосредованной транскрипционной активности, в NAc или OFC блокирует их. ключевые эффекты воздействия наркотиков 14,22–24 . Это указывает на то, что ΔFosB необходим и достаточен для многих изменений, вызываемых в мозге хроническим воздействием лекарств. ΔFosB также индуцируется в MSN NAc D1-типа при хроническом потреблении нескольких естественных наград, включая сахарозу, пищу с высоким содержанием жира, секс, бег колеса, что способствует этому потреблению 14,26–30. Это означает, что ΔFosB участвует в регуляции естественного вознаграждения в нормальных условиях и, возможно, во время состояний, подобных патологическому привыканию. ... 95% нейронов NAc представляют собой ГАМКергические MSN (нейроны со средними шипами), которые могут быть далее дифференцированы на те MSN, которые экспрессируют рецептор дофамина D1 (MSN типа D1) и экспрессируют динорфин и вещество P, а также те, которые экспрессируют дофамин D2 рецептора (MSN D2-типа) и экспрессируют энкефалин 132 . Лекарственная индукция ΔFosB 133,134 и эффекты ΔFosB и G9a на морфологию и поведение клеток различаются между MSN D1-типа и D2-типа 135 , и нейрональная активность этих двух типов клеток вызывает противоположные эффекты на полезные свойства кокаина 131. ... Около 1-2% нейронов NAc представляют собой аспиновые большие холинергические интернейроны, которые, как было показано, играют важную роль в кокаиновом вознаграждении 130 , и такое же количество ГАМКергических интернейронов, функция которых менее изучена.
- ^ a b c d e Блюм К., Вернер Т., Карнес С., Карнес П., Бовиррат А., Джордано Дж., Оскар-Берман М., Голд М. (2012). «Секс, наркотики и рок-н-ролл: гипотеза общей мезолимбической активации как функция полиморфизма гена вознаграждения» . Журнал психоактивных препаратов . 44 (1): 38–55. DOI : 10.1080 / 02791072.2012.662112 . PMC 4040958 . PMID 22641964 .
Было обнаружено, что ген deltaFosB в NAc имеет решающее значение для усиления эффектов сексуального вознаграждения. Питчерс и его коллеги (2010) сообщили, что сексуальный опыт вызывает накопление DeltaFosB в нескольких лимбических областях мозга, включая NAc, медиальную префронтальную кору, VTA, хвостатую часть и скорлупу, но не в медиальном преоптическом ядре. Затем индукция c-Fos, нижестоящая (репрессированная) мишень DeltaFosB, была измерена у опытных половым путем и наивных животных. Количество индуцированных спариванием клеток c-Fos-IR было значительно снижено у животных, имеющих опыт сексуальной жизни, по сравнению с контрольными животными, не подвергавшимися сексуальному воздействию. Наконец, уровнями DeltaFosB и его активностью в NAc манипулировали с помощью вирусно-опосредованного переноса генов, чтобы изучить его потенциальную роль в опосредовании сексуального опыта и облегчении сексуальной активности, вызванном опытом.Животные со сверхэкспрессией DeltaFosB демонстрировали повышенное облегчение сексуальной активности с сексуальным опытом по сравнению с контролем. Напротив, экспрессия DeltaJunD, доминантно-отрицательного связывающего партнера DeltaFosB, ослабляла индуцированное сексуальным опытом облегчение сексуальной активности и замедляла долгосрочное поддержание фасилитации по сравнению с группой сверхэкспрессии DeltaFosB. В совокупности эти данные подтверждают критическую роль экспрессии DeltaFosB в NAc в усиливающих эффектах сексуального поведения и индуцированного сексуальным опытом облегчения сексуальной активности. ... и наркомания, и сексуальная зависимость представляют собой патологические формы нейропластичности наряду с появлением аберрантного поведения, включающего каскад нейрохимических изменений, главным образом в цепях вознаграждения мозга.
- ^ Goto Y, O'Donnell P (февраль 2001). «Синхронная активность в гиппокампе и прилежащем ядре in vivo» . Журнал неврологии . 21 (4): RC131. DOI : 10.1523 / jneurosci.21-04-j0003.2001 . PMC 6762233 . PMID 11160416 .
- ^ Malenka RC, Нестлер EJ, Хайман SE (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: Фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. С. 175–176. ISBN 978-0-07-148127-4.
В головном мозге гистамин синтезируется исключительно нейронами с их клеточными телами в туберомаммиллярном ядре (TMN), которое находится внутри заднего гипоталамуса. У человека примерно 64000 гистаминергических нейронов на каждой стороне. Эти клетки распространяются по всему головному и спинному мозгу. Области, которые получают особенно плотные проекции, включают кору головного мозга, гиппокамп, неостриатум, прилежащее ядро, миндалевидное тело и гипоталамус. ... В то время как наиболее охарактеризованная функция гистаминовой системы в головном мозге - регуляция сна и возбуждения, гистамин также участвует в обучении и памяти ... Также оказывается, что гистамин участвует в регуляции питания и энергетического баланса.
- ^ Барро M, Sesack SR, Georges F, Pistis M, Hong S, Jhou TC (октябрь 2012). «Торможение дофаминовых систем: новая основная структура ГАМК для мезолимбических и нигростриатальных функций» . Журнал неврологии . 32 (41): 14094–101. DOI : 10.1523 / JNEUROSCI.3370-12.2012 . PMC 3513755 . PMID 23055478 .
- ^ Ферра S, Lluís С, Justinova Z, Quiroz С, Orru М, G Navarro, Канел Е.И., Франко R, Голдберг SR (июнь 2010 г.). «Аденозин-каннабиноидный рецептор взаимодействия. Значение для стриатальной функции» . Br. J. Pharmacol . 160 (3): 443–453. DOI : 10.1111 / j.1476-5381.2010.00723.x . PMC 2931547 . PMID 20590556 .
Два класса MSN, которые гомогенно распределены в полосатом теле, можно различить по их выходной связности и экспрессии дофаминовых и аденозиновых рецепторов и нейропептидов. В дорсальном полосатом теле (в основном представленном хвостатым ядром-скорлупой) энкефалинергические MSN соединяют полосатое тело с бледным шаром (латеральный бледный шар) и экспрессируют пептид энкефалин и высокую плотность рецепторов дофамина D2 и аденозина A2A (они также экспрессируют аденозин. A1 рецепторы), в то время как динорфинергические MSN соединяют полосатое тело с черной субстанцией (pars compacta и reticulata) и энтопедункулярным ядром (medial globus pallidus) и экспрессируют пептиды динорфин и вещество P и дофамин D1 и аденозин A1, но не рецепторы A2A ...Эти два различных фенотипа MSN также присутствуют в вентральном полосатом теле (в основном представленном прилежащим ядром и обонятельным бугорком). Однако, хотя они фенотипически идентичны своим дорсальным собратьям, у них есть некоторые различия в отношении связности. Во-первых, не только энкефалинэргические, но и динорфинэргические MSNs проецируются на вентральный аналог латерального бледного шара, вентральный бледный шар, который, фактически, обладает характеристиками как латерального, так и медиального бледного шара в его афферентной и эфферентной связности. В дополнение к вентральному паллидуму, медиальному бледному шару и черной субстанции-VTA, вентральное полосатое тело посылает проекции на расширенную миндалину, латеральный гипоталамус и тегментальное ядро педункулопонтина. ...Также важно отметить, что небольшой процент MSNs имеют смешанный фенотип и экспрессируют как рецепторы D1, так и D2 (Surmeier et al., 1996).
- ^ Ниси A, Куроива M, Шуто T (июль 2011). «Механизмы модуляции передачи сигналов рецептора допамина d (1) в нейронах полосатого тела» . Фронт нейроанат . 5 : 43. DOI : 10,3389 / fnana.2011.00043 . PMC 3140648 . PMID 21811441 .
Дофамин играет критически важную роль в регуляции психомоторных функций мозга (Bromberg-Martin et al., 2010; Cools, 2011; Gerfen and Surmeier, 2011). Рецепторы дофамина представляют собой суперсемейство рецепторов, связанных с гепталическим G-белком, и подразделяются на две категории, D1-подобные (D1, D5) и D2-подобные (D2, D3, D4) рецепторы, в зависимости от функциональных свойств стимулировать аденилатциклазу. (AC) через Gs / olf и ингибировать AC через Gi / o, соответственно ... Было продемонстрировано, что рецепторы D1 образуют гетероолигомер с рецепторами D2, и что гетероолигомер рецептора D1-D2 предпочтительно соединяется с Gq / Передача сигналов PLC (Rashid et al., 2007a, b). Экспрессия дофаминовых рецепторов D1 и D2 в значительной степени разделена в нейронах прямого и непрямого пути в дорсальном полосатом теле соответственно (Gerfen et al., 1990; Hersch et al., 1995; Heiman et al.,2008 г.). Однако известно, что некоторая часть нейронов со средними шипами экспрессирует рецепторы как D1, так и D2 (Hersch et al., 1995). Анализ экспрессии генов с использованием метода ОТ-ПЦР одиночных клеток показал, что 40% нейронов со средними шипами экспрессируют мРНК рецепторов D1 и D2 (Surmeier et al., 1996).
- ^ Б с д е е Shirayama Y, Chaki S (октябрь 2006 г.). «Нейрохимия прилежащего ядра и ее связь с депрессией и антидепрессивным действием у грызунов» . Современная нейрофармакология . 4 (4): 277–91. DOI : 10.2174 / 157015906778520773 . PMC 2475798 . PMID 18654637 .
- ^ Meredith GE, Agolia R, Arts MP, Груневеген HJ, Zahm DS (сентябрь 1992). «Морфологические различия между проекционными нейронами ядра и оболочки в прилежащем ядре крысы». Неврология . 50 (1): 149–62. DOI : 10.1016 / 0306-4522 (92) 90389-J . PMID 1383869 .
- ^ a b c Meredith GE, Pennartz CM, Groenewegen HJ (1993). «Клеточная основа для химической передачи сигналов в прилежащем ядре». Химическая передача сигналов в базальных ганглиях . Прогресс в исследованиях мозга. 99 . С. 3–24. DOI : 10.1016 / s0079-6123 (08) 61335-7 . ISBN 978-0-444-81562-0. PMID 7906426 .
- ^ a b c d Berridge KC, Kringelbach ML (май 2015 г.). «Системы удовольствия в мозгу» . Нейрон . 86 (3): 646–64. DOI : 10.1016 / j.neuron.2015.02.018 . PMC 4425246 . PMID 25950633 .
- ^ Baliki MN, Мансур A, Бария AT, Huang L, Berger SE, Поля HL, Apkarian AV (октябрь 2013 г. ). «Разделение прилежащего человека на предполагаемое ядро и оболочку разъединяет кодирование ценностей вознаграждения и боли» . Журнал неврологии . 33 (41): 16383–93. DOI : 10.1523 / JNEUROSCI.1731-13.2013 . PMC 3792469 . PMID 24107968 .
Недавние данные показывают, что инактивация рецепторов D2 в непрямом стриатопаллидном пути у грызунов необходима как для приобретения, так и для выражения аверсивного поведения, а активация рецептора D1 прямого пути контролирует обучение, основанное на вознаграждении (Hikida et al., 2010; Hikida et al. ., 2013). Похоже, мы можем сделать вывод, что прямые и непрямые пути NAc через рецепторы D1 и D2 подчиняют различные роли ожидания и оценки в оболочке и ядре NAc, что согласуется с наблюдениями относительно пространственной сегрегации и разнообразия ответов дофаминергических нейронов среднего мозга. для условий вознаграждения и отвращения, некоторые из них кодируют мотивационную ценность, другие - мотивационную значимость, каждая из которых связана с различными мозговыми сетями и играет определенную роль в мотивационном контроле (Bromberg-Martin et al., 2010; Cohen et al., 2012;Lammel et al., 2013). ... Таким образом, предыдущие результаты в сочетании с текущими наблюдениями предполагают, что ответ NAc pshell отражает сигнал прогнозирования / ожидания или значимости, а ответ NAc pcore является оценочным ответом (сигнал прогнозирования вознаграждения), который сигнализирует об отрицательном значении подкрепления. прекращения боли (т. е. ожидаемого обезболивания).
- ^ a b Cartoni E, Puglisi-Allegra S, Baldassarre G (ноябрь 2013 г.). «Три принципа действия: Павловско-инструментальная гипотеза переноса» . Границы поведенческой нейробиологии . 7 : 153. DOI : 10,3389 / fnbeh.2013.00153 . PMC 3832805 . PMID 24312025 .
- ^ Ричард Дж. М., Кастро, округ Колумбия, Difeliceantonio AG, Робинсон MJ, Berridge KC (ноябрь 2013 г.). «Отображение мозговых цепей вознаграждения и мотивации: по стопам Энн Келли» . Неврология и биоповеденческие обзоры . 37 (9 Pt A): 1919–31. DOI : 10.1016 / j.neubiorev.2012.12.008 . PMC 3706488 . PMID 23261404 .
Рисунок 3: Нейронные цепи, лежащие в основе мотивированного «желания» и гедонистического «симпатии».
- ^ Берридж KC, Robinson TE, Aldridge JW (февраль 2009). «Разделение компонентов вознаграждения:« симпатия »,« желание »и обучение» . Текущее мнение в фармакологии . 9 (1): 65–73. DOI : 10.1016 / j.coph.2008.12.014 . PMC 2756052 . PMID 19162544 .
- ^ a b Nestler EJ (декабрь 2013 г.). «Клеточная основа памяти при зависимости» . Диалоги в клинической неврологии . 15 (4): 431–43. PMC 3898681 . PMID 24459410 .
НЕСМОТРЯ НА ВАЖНОСТЬ МНОГОЧИСЛЕННЫХ ПСИХОСОЦИАЛЬНЫХ ФАКТОРОВ, В СВОЕЙ ОСНОВНОЙ ЦЕЛЕ НАРКОЗАВИСИМОСТЬ ВКЛЮЧАЕТ БИОЛОГИЧЕСКИЙ ПРОЦЕСС: способность многократного воздействия наркотика, вызывающего злоупотребление, вызывать изменения в уязвимом мозге, которые вызывают компульсивный поиск и прием наркотиков, а также потерю контроля над употреблением наркотиков, которые определяют состояние зависимости. ... Большое количество литературы продемонстрировало, что такая индукция ΔFosB в нейронах NAc D1-типа увеличивает чувствительность животного к лекарству, а также естественное вознаграждение и способствует самостоятельному введению лекарства, предположительно посредством процесса положительного подкрепления ... Например, , субрегионы оболочки и ядра NAc обнаруживают различия в индуцированной лекарственными средствами синаптической пластичности, как и D1- по сравнению с D2-типами средние шиповатые нейроны в каждой подобласти. 60,63,64,67
- ^ Dumitriu D, Laplant Q, Гроссман Ю.С., Dias C, Janssen WG, Russo SJ, Morrison JH, Нестлер EJ (май 2012). «Субрегиональная, дендритная компартмент и специфичность подтипа шипов в регуляции кокаина дендритных шипов в прилежащем ядре» . Журнал неврологии . 32 (20): 6957–66. DOI : 10.1523 / JNEUROSCI.5718-11.2012 . PMC 3360066 . PMID 22593064 .
Устойчивое изменение плотности позвоночника в ядре, но не в оболочке, хорошо согласуется с устоявшейся идеей о том, что оболочка преимущественно участвует в развитии зависимости, в то время как ядро опосредует долгосрочное выполнение выученного поведения, связанного с зависимостью (Ito et al., 2004 ; Di Chiara, 2002; Meredith et al., 2008). В соответствии с идеей, что ядро NAc является локусом длительной нейропластичности, вызванной лекарственными средствами, несколько исследований показали, что электрофизиологические изменения в ядре сохраняются дольше, чем их аналоги в оболочке. ... Более того, представленные здесь данные подтверждают идею о том, что оболочка NAc предпочтительно участвует в немедленном вознаграждении за лекарство, в то время как ядро может играть более явную роль в долгосрочных аспектах зависимости.
- ^ Pontieri FE, Tanda G, Di Chiara G (декабрь 1995). «Внутривенный кокаин, морфин и амфетамин преимущественно увеличивают внеклеточный дофамин в« оболочке »по сравнению с« ядром »прилежащего ядра крысы» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (26): 12304–8. Bibcode : 1995PNAS ... 9212304P . DOI : 10.1073 / pnas.92.26.12304 . JSTOR 2369093 . PMC 40345 . PMID 8618890 .
- ^ a b c Ди Кьяра Джи (декабрь 2002 г.). «Оболочка прилежащего ядра и дофамин ядра: различная роль в поведении и зависимости». Поведенческие исследования мозга . 137 (1–2): 75–114. DOI : 10.1016 / s0166-4328 (02) 00286-3 . PMID 12445717 .
- ^ Eiden LE, Weihe E (январь 2011). «VMAT2: динамический регулятор моноаминергической нейрональной функции мозга, взаимодействующий с наркотиками, вызывающими злоупотребление» . Летопись Нью-Йоркской академии наук . 1216 (1): 86–98. Bibcode : 2011NYASA1216 ... 86E . DOI : 10.1111 / j.1749-6632.2010.05906.x . PMC 4183197 . PMID 21272013 .
VMAT2 является везикулярным переносчиком ЦНС не только для биогенных аминов DA, NE, EPI, 5-HT и HIS, но, вероятно, также для следовых аминов TYR, PEA и тиронамина (THYR) ... [Следы аминергических] нейронов в ЦНС млекопитающих можно идентифицировать как нейроны, экспрессирующие VMAT2 для хранения, и биосинтетический фермент декарбоксилазу ароматических аминокислот (AADC).
- ^ Барро М, Маринелли М, Abrous Д.Н., ROUGE-Pont F, Le Moal M, Piazza PV (март 2000). «Дофаминергическая гиперчувствительность оболочки прилежащего ядра зависит от гормонов». Европейский журнал нейробиологии . 12 (3): 973–9. DOI : 10,1046 / j.1460-9568.2000.00996.x . PMID 10762327 .
- ↑ Akiyama G, Ikeda H, Matsuzaki S, Sato M, Moribe S, Koshikawa N, Cools AR (июнь 2004 г.). «Рецепторы GABAA и GABAB в оболочке прилежащего ядра по-разному модулируют опосредованное рецептором допамина и ацетилхолина повороты». Нейрофармакология . 46 (8): 1082–8. DOI : 10.1016 / j.neuropharm.2004.02.007 . PMID 15111014 .
- ^ Смит-Roe SL, Sadeghian K, Kelley AE (август 1999). «Пространственное обучение и производительность в лабиринте с лучевой рукой ухудшаются после блокады рецептора N-метил-D-аспартата (NMDA) в субрегионах полосатого тела». Поведенческая неврология . 113 (4): 703–17. DOI : 10.1037 / 0735-7044.113.4.703 . PMID 10495079 .
- ^ Giertler C, Бона I, Hauber W (март 2005). «Вовлечение рецепторов NMDA и AMPA / KA в ядро прилежащего ядра в инструментальном обучении, управляемом подсказками, предсказывающими вознаграждение». Европейский журнал нейробиологии . 21 (6): 1689–702. DOI : 10.1111 / j.1460-9568.2005.03983.x . PMID 15845096 .
- ^ a b c d e f g h i j k l m n o p q Olsen CM (декабрь 2011 г.). «Естественные награды, нейропластичность и немедикаментозные зависимости» . Нейрофармакология . 61 (7): 1109–22. DOI : 10.1016 / j.neuropharm.2011.03.010 . PMC 3139704 . PMID 21459101 .
Перекрестная сенсибилизация также является двунаправленной, поскольку введение амфетамина в анамнезе способствует сексуальному поведению и усиливает связанное с этим повышение NAc DA ... Как описано для пищевого вознаграждения, сексуальный опыт также может привести к активации связанных с пластичностью сигнальных каскадов. Фактор транскрипции delta FosB увеличивается в NAc, PFC, дорсальном полосатом теле и VTA после повторяющегося сексуального поведения (Wallace et al., 2008; Pitchers et al., 2010b). Это естественное увеличение delta FosB или вирусная избыточная экспрессия delta FosB в NAc модулирует сексуальную активность, а блокада NAc delta FosB ослабляет это поведение (Hedges et al., 2009; Pitchers et al., 2010b). Более того, вирусная сверхэкспрессия delta FosB усиливает обусловленное предпочтение места для окружающей среды в сочетании с сексуальным опытом (Hedges et al., 2009). ...
Таблица 1 - ↑ Day JJ, Carelli RM (апрель 2007 г.). «Прилежащее ядро и Павловское вознаграждение» . Невролог . 13 (2): 148–59. DOI : 10.1177 / 1073858406295854 . PMC 3130622 . PMID 17404375 .
В соответствии с другими сообщениями (Nicola and others 2004; Taha and Fields 2006) преобладающим ответом нейронов NAc на инфузию сахарозы было снижение активности (рис. 2). Как видно из рисунка 2, одни и те же нейроны проявляли противоположные ответы, когда аверсивный раствор хинина вводился внутрь. Одна из гипотез предполагает, что ингибирование, наблюдаемое во время доставки вознаграждения, происходит среди ГАМК-содержащих нейронов NAc, которые проецируются на важные двигательные области, такие как вентральный паллидум (VP).
- ^ Carlezon WA, Томас MJ (2009). «Биологические субстраты награды и отвращения: гипотеза активности прилежащего ядра» . Нейрофармакология . 56 Дополнение 1: 122–32. DOI : 10.1016 / j.neuropharm.2008.06.075 . PMC 2635333 . PMID 18675281 .
При совместном рассмотрении эти исследования предоставили два важных доказательства, которые сыграли важную роль в формулировании нашей текущей рабочей гипотезы: во-первых, что дофамин-зависимое вознаграждение ослабляется блокадой D2-подобных рецепторов, которые являются ингибирующими рецепторами, преимущественно выраженными. в NAc на MSN непрямого пути; и, во-вторых, событий, которые, как ожидается, уменьшат общую возбудимость NAc (например, стимуляция Gi-связанных опиоидных рецепторов, снижение стимуляции возбуждающих рецепторов NMDA, снижение возбуждающего входа), достаточно для вознаграждения. Эта интерпретация привела к разработке модели вознаграждения, в которой критическим событием является уменьшение активации MSN в NAc.
- ^ Costa VD, Lang PJ, Сабатинелли D, F Версаче, Брэдли М. (сентябрь 2010). «Эмоциональные образы: оценка удовольствия и возбуждения в цепи вознаграждения мозга» . Картирование человеческого мозга . 31 (9): 1446–57. DOI : 10.1002 / hbm.20948 . PMC 3620013 . PMID 20127869 .
- ^ Сабатинелли D, Брэдли М., Ланг PJ, Коста - VD, Версаче F (сентябрь 2007). «Удовольствие, а не видимость активирует прилежащее ядро человека и медиальную префронтальную кору» . Журнал нейрофизиологии . 98 (3): 1374–9. DOI : 10,1152 / jn.00230.2007 . PMID 17596422 .
- ^ Mogenson GJ, Джонс DL, Иий CY (1980). «От мотивации к действию: функциональный интерфейс между лимбической системой и двигательной системой». Прогресс нейробиологии . 14 (2–3): 69–97. DOI : 10.1016 / 0301-0082 (80) 90018-0 . PMID 6999537 .
- ^ Hart G, Leung BK, Balleine BW (февраль 2014). «Дорсальный и вентральный потоки: особая роль полосатого тела в приобретении и выполнении целенаправленных действий» . Нейробиология обучения и памяти . 108 : 104–18. DOI : 10.1016 / j.nlm.2013.11.003 . PMC 4661143 . PMID 24231424 .
- ^ Castro DC, Коул SL, Берридж KC (2015). «Роли бокового гипоталамуса, прилежащего ядра и брюшной паллидума в еде и голоде: взаимодействие между гомеостатической схемой и схемой вознаграждения» . Границы системной нейробиологии . 9 : 90. DOI : 10,3389 / fnsys.2015.00090 . PMC 4466441 . PMID 26124708 .
- ^ Берридж KC, Kringelbach ML (июнь 2013). «Неврология аффекта: мозговые механизмы удовольствия и неудовольствия» . Текущее мнение в нейробиологии . 23 (3): 294–303. DOI : 10.1016 / j.conb.2013.01.017 . PMC 3644539 . PMID 23375169 .
- ^ Инь HH, Ostlund SB, Balleine BW (октябрь 2008). «Обучение, направленное на вознаграждение, помимо допамина в прилежащем ядре: интегративные функции сетей кортико-базальных ганглиев» . Европейский журнал нейробиологии . 28 (8): 1437–48. DOI : 10.1111 / j.1460-9568.2008.06422.x . PMC 2756656 . PMID 18793321 .
- ↑ Soares-Cunha C, Coimbra B, Sousa N, Rodrigues AJ (сентябрь 2016 г.). «Переоценка стриатальных D1- и D2-нейронов в вознаграждении и отвращении» (PDF) . Неврология и биоповеденческие обзоры . 68 : 370–386. DOI : 10.1016 / j.neubiorev.2016.05.021 . hdl : 1822/47044 . PMID 27235078 .
- Перейти ↑ Soares-Cunha C, Coimbra B, Domingues AV, Vasconcelos N, Sousa N, Rodrigues AJ (19 апреля 2018 г.). «Микросхема Nucleus Accumbens, лежащая в основе повышения мотивации, обусловленного D2-MSN» . eNeuro . 5 (2): ENEURO.0386–18.2018. DOI : 10.1523 / ENEURO.0386-18.2018 . PMC 5957524 . PMID 29780881 .
Оптогенетическая активация D2-MSN снижает активность вентрального паллида (VP), снижая подавляющий тон к VTA, что приводит к увеличению дофаминергической активности. Важно отметить, что оптогенетическая активация концов D2-MSN в VP была достаточной, чтобы повторить усиление мотивации.
- ↑ Ferris CF, Kulkarni P, Sullivan JM, Harder JA, Messenger TL, Febo M (январь 2005 г.). «Сосание щенка приносит больше удовольствия, чем кокаин: данные функциональной магнитно-резонансной томографии и трехмерного компьютерного анализа» . Журнал неврологии . 25 (1): 149–56. arXiv : 1510.02343 . DOI : 10.1523 / jneurosci.3156-04.2005 . PMC 6725197 . PMID 15634776 .
- Перейти ↑ Numan M (январь 2007 г.). «Мотивационные системы и нейронные схемы материнского поведения у крысы» . Психобиология развития . 49 (1): 12–21. DOI : 10.1002 / dev.20198 . PMID 17186513 .
- ^ Глокер ML, Langleben DD, Ruparel K, Loughead JW, Вальдес JN, Griffin MD, Sachser N Гур RC (июнь 2009). «Схема младенца модулирует систему вознаграждения мозга у нерожавших женщин» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (22): 9115–9. Bibcode : 2009PNAS..106.9115G . DOI : 10.1073 / pnas.0811620106 . JSTOR 40482823 . PMC 2690007 . PMID 19451625 .
- ^ а б Хайман С.Е., Маленка Р.С., Нестлер Э.Дж. (2006). «Нейронные механизмы зависимости: роль обучения и памяти, связанных с вознаграждением». Ежегодный обзор неврологии . 29 : 565–98. DOI : 10.1146 / annurev.neuro.29.051605.113009 . PMID 16776597 .
- ^ Steiner H, Ван Waes V (январь 2013). «Регулирование генов, связанных с зависимостью: риски воздействия когнитивных усилителей по сравнению с другими психостимуляторами» . Прогресс нейробиологии . 100 : 60–80. DOI : 10.1016 / j.pneurobio.2012.10.001 . PMC 3525776 . PMID 23085425 .
- ^ a b Ruffle JK (ноябрь 2014 г.). «Молекулярная нейробиология зависимости: что такое (Δ) FosB?». Американский журнал злоупотребления наркотиками и алкоголем . 40 (6): 428–37. DOI : 10.3109 / 00952990.2014.933840 . PMID 25083822 .
ΔFosB является важным фактором транскрипции, участвующим в молекулярных и поведенческих механизмах привыкания после многократного воздействия наркотиков. Образование ΔFosB во многих областях мозга и молекулярный путь, ведущий к образованию комплексов АР-1, хорошо изучены. Установление функционального назначения ΔFosB позволило дополнительно определить некоторые ключевые аспекты его молекулярных каскадов, включая такие эффекторы, как GluR2 (87,88), Cdk5 (93) и NFkB (100). Более того, многие из этих выявленных молекулярных изменений сейчас напрямую связаны со структурными, физиологическими и поведенческими изменениями, наблюдаемыми после хронического воздействия лекарств (60,95,97,102). Новые горизонты исследований молекулярной роли ΔFosB открыли эпигенетические исследования,и недавние достижения продемонстрировали роль ΔFosB, действующего на ДНК и гистоны, действительно какмолекулярный переключатель (34).
- ^ Kanehisa Лаборатории (29 октября 2014). «Алкоголизм - Homo sapiens (человек)» . KEGG Pathway . Проверено 31 октября 2014 года .
- ^ Ким Y, Teylan MA, Baron M, Сэндс A, Наим AC, Грингард P (февраль 2009). «Метилфенидат-индуцированное образование дендритных шипов и экспрессия DeltaFosB в прилежащем ядре» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (8): 2915–20. Bibcode : 2009PNAS..106.2915K . DOI : 10.1073 / pnas.0813179106 . PMC 2650365 . PMID 19202072 .
- ^ Кувшины К.К., Vialou В, Нестлер Е.Ю., Laviolette С.Р., Леман М.Н., Coolen Л.М. (февраль 2013 г. ). «Естественные и лекарственные награды действуют на общие механизмы нейронной пластичности с ΔFosB в качестве ключевого посредника» . Журнал неврологии . 33 (8): 3434–42. DOI : 10.1523 / JNEUROSCI.4881-12.2013 . PMC 3865508 . PMID 23426671 .
Наркотики, вызывающие злоупотребление, вызывают нейропластичность в естественном пути вознаграждения, особенно в прилежащем ядре (NAc), тем самым вызывая развитие и проявление аддиктивного поведения. ... В совокупности эти результаты демонстрируют, что злоупотребление наркотиками и естественное поощрение поведения воздействуют на общие молекулярные и клеточные механизмы пластичности, которые контролируют уязвимость к наркомании, и что эта повышенная уязвимость опосредуется ΔFosB и его нижестоящими транскрипционными мишенями. ... Сексуальное поведение очень полезно (Tenk et al., 2009), а сексуальный опыт вызывает сенсибилизированное поведение, связанное с наркотиками, включая перекрестную сенсибилизацию к локомоторной активности, вызванной амфетамином (Amph) (Bradley and Meisel, 2001; Pitchers et al. ., 2010a) и увеличенное вознаграждение Amph (Pitchers et al., 2010a). Более того,сексуальный опыт вызывает нейрональную пластичность в NAc, аналогичную той, которая вызывается воздействием психостимуляторов, включая увеличение плотности дендритных шипов (Meisel and Mullins, 2006; Pitchers et al., 2010a), изменение трафика рецепторов глутамата и снижение синаптической силы в префронтальной коре, отвечающей Нейроны оболочки NAc (Pitchers et al., 2012). Наконец, периоды воздержания от сексуального опыта оказались критическими для усиления вознаграждения Amph, спиногенеза NAc (Pitchers et al., 2010a) и трафика глутаматных рецепторов (Pitchers et al., 2012). Эти результаты показывают, что природное вознаграждение и награда за лекарство имеют общие механизмы нейронной пластичности.и снижение синаптической силы в нейронах оболочки NAc, отвечающих за префронтальную кору (Pitchers et al., 2012). Наконец, периоды воздержания от сексуального опыта оказались критическими для усиления вознаграждения Amph, спиногенеза NAc (Pitchers et al., 2010a) и трафика глутаматных рецепторов (Pitchers et al., 2012). Эти результаты показывают, что природное вознаграждение и награда за лекарство имеют общие механизмы нейронной пластичности.и снижение синаптической силы в нейронах оболочки NAc, отвечающих за префронтальную кору (Pitchers et al., 2012). Наконец, периоды воздержания от сексуального опыта оказались критическими для усиления вознаграждения Amph, спиногенеза NAc (Pitchers et al., 2010a) и трафика глутаматных рецепторов (Pitchers et al., 2012). Эти результаты показывают, что природное вознаграждение и награда за лекарство имеют общие механизмы нейронной пластичности.
- ^ Мозговые электроды помогают лечить депрессию , Обзор технологий , 26 апреля 2007 г.
- ^ Bewernick BH, Hurlemann R, Matusch А, Кайзер S, Груберт С, Hadrysiewicz В, Axmacher Н, Лемке М, Купер-Mahkorn D, Коэна MX, Брокманна Н, Lenartz Д, Sturm В, Schlaepfer ТЕ (январь 2010). «Глубокая стимуляция мозга Nucleus accumbens снижает вероятность депрессии и тревожности при устойчивой к лечению депрессии». Биологическая психиатрия . 67 (2): 110–6. DOI : 10.1016 / j.biopsych.2009.09.013 . PMID 19914605 .
- ^ Оомс P, Mantione M, Figee M, Schuurman PR, ван ден Munckhof P, Denys D (февраль 2014). «Глубокая стимуляция мозга при обсессивно-компульсивных расстройствах: долгосрочный анализ качества жизни». Журнал неврологии, нейрохирургии и психиатрии . 85 (2): 153–8. DOI : 10.1136 / jnnp-2012-302550 . PMID 23715912 .
- ^ "Спорная хирургия от наркозависимости сжигает центр удовольствия мозга" Автор Майя Салавиц. 13 декабря 2012 г.
- ^ "Китай запрещает необратимую мозговую процедуру" Автор Замиска Николас. 28 апреля 2008 г. The Wall Street Journal
- ^ Scott DJ, Stohler CS, Egnatuk CM, Ван H, Koeppe Р.А., Субьета JK (июль 2007). «Индивидуальные различия в реакции на вознаграждение объясняют ожидания и эффекты, вызванные плацебо». Нейрон . 55 (2): 325–36. DOI : 10.1016 / j.neuron.2007.06.028 . PMID 17640532 . Краткое содержание - Cell Press (18 июля 2007 г.).
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме Nucleus accumbens . |
- Роль прилежащего ядра в цепи вознаграждения. Часть «Мозг сверху донизу». на thebrain.mcgill.ca
- Nucleus Accumbens - база данных, ориентированная на клетки
- Окрашенные изображения срезов головного мозга, включающие «ядро% 20accumbens», в проекте BrainMaps.