| Саркомерные мышечные повязки | |
|---|---|
 Изображение саркомера | |
| Подробности | |
| Часть | Поперечно-полосатые мышцы |
| Идентификаторы | |
| латинский | саркомерум |
| MeSH | D012518 |
| TH | H2.00.05.0.00008 |
| FMA | 67895 |
| Анатомические термины микроанатомии | |
Саркомера (греческий σάρξ саркс «плоть», μέρος мерос «часть») является сложным единицей поперечнополосатой мышечной ткани . Это повторяющийся элемент между двумя Z-линиями. Скелетные мышцы состоят из тубулярных мышечных клеток (называемых мышечными волокнами или миофибриллами), которые образуются во время эмбрионального миогенеза . Мышечные волокна содержат многочисленные трубчатые миофибриллы . Миофибриллы состоят из повторяющихся участков саркомеров, которые под микроскопом выглядят как чередующиеся темные и светлые полосы. Саркомеры состоят из длинных волокнистых белков в виде нитей, которые скользят друг мимо друга, когда мышца сокращается или расслабляется. costamereэто другой компонент, который соединяет саркомер с сарколеммой .
Двумя важными белками являются миозин , который образует толстую нить, и актин , который формирует тонкую нить. Миозин имеет длинный волокнистый хвост и шаровидную головку, которая связывается с актином. Головка миозина также связывается с АТФ , который является источником энергии для движения мышц. Миозин может связываться с актином только тогда, когда сайты связывания на актине подвергаются воздействию ионов кальция.
Молекулы актина связаны с Z-линией, которая образует границы саркомера. Другие полосы появляются, когда саркомер расслаблен. [1]
Миофибриллы гладкомышечных клеток не расположены в саркомеры.
Группы [ править ]

Саркомеров дают скелетной и сердечной мышцы их исчерчена внешний вид , [1] , который был впервые описан Ван Левенгук . [2]
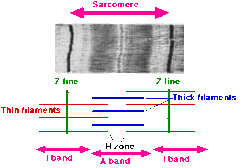
- Саркомер определяется как сегмент между двумя соседними Z-линиями (или Z-дисками, или Z-телами). На электронных микрофотографиях поперечно-полосатой мышцы Z-линия (от немецкого «Zwischenscheibe», диск между I-полосами) выглядит как серия темных линий. Они действуют как якорная точка актиновых филаментов.
- Вокруг Z-линии находится область I-диапазона (для изотропного ). I-полоса - это зона тонких нитей, на которую не накладываются толстые нити (миозин).
- После I-полосы идет A-полоса (для анизотропии ). Названы из-за их свойств под микроскопом в поляризованном свете . Полоса А содержит всю длину одной толстой нити. В анизотропной полосе присутствуют как толстые, так и тонкие волокна .
- Внутри диапазона A находится более светлая область, называемая зоной H (от немецкого heller, более яркая ). Названы из-за их более легкого внешнего вида под поляризационным микроскопом. H-полоса - это зона толстых нитей, в которой нет актина.
- Внутри H-зоны проходит тонкая M-линия (от немецкого «Mittelscheibe», диск в середине саркомера), образованная перекрестно соединяющими элементами цитоскелета.
Отношения между белками и областями саркомера следующие:
- Актиновые нити, тонкие нити, являются основным компонентом I-полосы и переходят в A-полосу.
- Миозиновые нити, толстые нити, биполярны и проходят через А-полосу. Они сшиты в центре полосой М.
- Гигантский белок тайтин (коннектин) простирается от Z-линии саркомера, где он связывается с системой толстых филаментов (миозин), до M-полосы, где, как считается, он взаимодействует с толстыми филаментами. Титин (и его изоформы сплайсинга) - самый крупный высокоэластичный белок, встречающийся в природе. Он обеспечивает сайты связывания для множества белков и, как полагают, играет важную роль в качестве управителя саркомеров и схемы сборки саркомера.
- Предполагается , что другой гигантский белок, небулин , распространяется вдоль тонких нитей и всей I-полосы. Считается, что, подобно тайтину, он действует как молекулярная линейка для сборки тонких нитей.
- Несколько белков, важных для стабильности саркомерной структуры, обнаружены в Z-линии, а также в M-полосе саркомера.
- Актиновые филаменты и молекулы тайтина поперечно связаны в Z-диске через альфа-актинин белка Z-линии.
- Белки M-полосы миомезин, а также C-белок сшивают систему толстых филаментов (миозины) и часть M-полосы тайтина (эластичные филаменты).
- М-линия также связывает креатинкиназу, которая облегчает реакцию АДФ и фосфокреатина на АТФ и креатин.
- Взаимодействие между актиновыми и миозиновыми филаментами в А-полосе саркомера отвечает за сокращение мышц (на основе модели скользящего филамента ). [1]
Сокращение [ править ]
Белок тропомиозин покрывает миозин-связывающие участки молекул актина в мышечной клетке. Чтобы мышечная клетка сократилась, тропомиозин должен быть перемещен, чтобы открыть участки связывания на актине. Ионы кальция связываются с молекулами тропонина С (которые рассредоточены по всему белку тропомиозина) и изменяют структуру тропомиозина, заставляя его открывать сайт связывания поперечного мостика на актине.
Концентрация кальция в мышечных клетках контролируется саркоплазматическим ретикулумом , уникальной формой эндоплазматического ретикулума в саркоплазме .
Мышечные клетки стимулируются, когда двигательный нейрон высвобождает нейромедиатор ацетилхолин , который проходит через нервно-мышечное соединение (синапс между конечным бутоном нейрона и мышечной клеткой). Ацетилхолин связывается с постсинаптическим никотиновым рецептором ацетилхолина . Изменение конформации рецептора позволяет притоку ионов натрия и инициированию постсинаптического потенциала действия . Потенциал действия затем проходит по Т-канальцам (поперечным канальцам), пока не достигнет саркоплазматической сети. Здесь деполяризованная мембрана активирует потенциалзависимые кальциевые каналы L-типа., присутствует в плазматической мембране. Кальциевые каналы L-типа находятся в тесной связи с рецепторами рианодина, присутствующими в саркоплазматической сети. Входящий поток кальция из кальциевых каналов L-типа активирует рианодиновые рецепторы для высвобождения ионов кальция из саркоплазматического ретикулума. Этот механизм называется кальциевым высвобождением кальция (CICR). Неизвестно, вызывает ли открытие рианодиновых рецепторов физическое открытие кальциевых каналов L-типа или присутствие кальция. Отток кальция обеспечивает доступ головкам миозина к участкам связывания поперечных мостиков с актином, что способствует сокращению мышц. [3]
Сокращение мышц заканчивается, когда ионы кальция закачиваются обратно в саркоплазматический ретикулум, позволяя сократительному аппарату и, таким образом, мышечным клеткам расслабиться.
При сокращении мышцы А-полосы не меняют своей длины (1,85 мкм в скелетных мышцах млекопитающих) [3], тогда как I-полосы и H-зона укорачиваются. Это приводит к тому, что линии Z сближаются.
Отдых [ править ]
В состоянии покоя головка миозина связана с молекулой АТФ в низкоэнергетической конфигурации и не может получить доступ к сайтам связывания поперечного мостика на актине. Однако миозиновая головка может гидролизовать АТФ в аденозиндифосфат (АДФ и неорганический фосфат-ион. Часть энергии, высвобождаемой в этой реакции, изменяет форму миозиновой головки и превращает ее в высокоэнергетическую конфигурацию. За счет процесса связывания) к актину головка миозина высвобождает АДФ и неорганический фосфат-ион, изменяя свою конфигурацию обратно на низкоэнергетическую. Миозин остается прикрепленным к актину в состоянии, известном как окоченение, пока новый АТФ не свяжет головку миозина. Это связывание АТФ с миозином высвобождает актин путем диссоциации поперечного мостика. Миозин, связанный с АТФ, готов к следующему циклу, начиная с гидролиза АТФ.
Полоса А видна в виде темных поперечных линий на миофибриллах; I-полоса видна как слегка окрашивающиеся поперечные линии, а Z-линия видна как темные линии, разделяющие саркомеры на уровне светового микроскопа.
Хранилище [ править ]
Большинство мышечных клеток хранят достаточно АТФ только для небольшого числа мышечных сокращений. Хотя мышечные клетки также накапливают гликоген , большая часть энергии, необходимой для сокращения, поступает из фосфагенов. Один из таких фосфагенов , креатинфосфат , используется для обеспечения АДФ фосфатной группой для синтеза АТФ у позвоночных . [3]
Сравнительная структура [ править ]
Структура саркомера влияет на его функцию несколькими способами. Перекрытие актина и миозина приводит к появлению кривой длина-напряжение , которая показывает, как уменьшается выходная сила саркомера, если мышца растягивается так, что меньше поперечных мостиков может образовываться или сжиматься до тех пор, пока актиновые филаменты не столкнутся друг с другом. Длина актиновых и миозиновых нитей (вместе взятая как длина саркомера) влияет на силу и скорость - более длинные саркомеры имеют больше поперечных мостиков и, следовательно, большую силу, но имеют меньший диапазон укорочения. Позвоночные имеют очень ограниченный диапазон длин саркомеров с примерно одинаковой оптимальной длиной (длина при пиковом напряжении длины) во всех мышцах человека, а также между видами. Членистоногиетем не менее, демонстрируют огромные различия (более семи раз) в длине саркомера как между видами, так и между мышцами у одного человека. Причины отсутствия существенной изменчивости саркомеров у позвоночных до конца не известны. [ необходима цитата ]
Ссылки [ править ]
- ^ a b c Рис, Джейн; Кэмпбелл, Нил (2002). Биология . Сан-Франциско: Бенджамин Каммингс . ISBN 0-8053-6624-5.
- ^ Martonosi, AN (2000-01-01). «Электричество животных, Са2 + и сокращение мышц. Краткая история исследования мышц» . Acta Biochimica Polonica . 47 (3): 493–516. DOI : 10,18388 / abp.2000_3974 . ISSN 0001-527X . PMID 11310955 .
- ^ a b c Либер (2002). Структура, функция и пластичность скелетных мышц: физиологические основы реабилитации (2-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0781730617.
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме саркомеров . |
- MBInfo: Саркомер
- MBInfo: Сокращающееся волокно
- Видео о мышечных тканях
- Гистологическое изображение: 21601ooa - Система обучения гистологии в Бостонском университете - «Ультраструктура клетки: саркоплазма скелетных мышц»
- Медицинская Мнемоника .com : 50 379 107
- Изображения, созданные антителами к полосатым полоскам
- Сокращение мышц для чайников
- Модельное представление саркомера