| Селективный модулятор рецепторов глюкокортикоидов | |
|---|---|
| Класс препарата | |
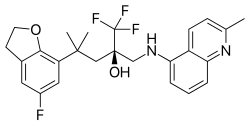 Химическая структура из mapracorat , один из самых дальних развитых SEGRAs. [1] | |
| Идентификаторы класса | |
| Синонимы | SEGRM; SEGRA; SEGRAM; ДИГРА |
| Использовать | Потенциально атопический дерматит , глаукома , катаракта , глазные инфекции и др. |
| Биологическая мишень | Глюкокортикоидный рецептор |
| Химический класс | Стероидный ; нестероидный |
| В Викиданных | |
Селективные модуляторы рецепторов глюкокортикоидов ( SEGRMs ) и селективные агонисты рецепторов глюкокортикоидов ( SEGRAs ) , ранее известные как диссоциированные глюкокортикоидный агонисты рецепторов ( DIGRAs ) представляют собой класс экспериментальных лекарственных средств , предназначенных для обмена многих из желательных противовоспалительных , иммуносупрессивных или противораковых свойств классического глюкокортикоида лекарства, но с меньшим количеством побочных эффектов, таких как атрофия кожи . Хотя доклинические доказательства противовоспалительного действия SEGRAM достигают апогея, [2] в настоящее время эффективность этих SEGRAM при раке в значительной степени неизвестна.
Селективные агонисты рецепторов глюкокортикоидов (SEGRA) исторически и обычно имеют стероидную структуру, в то время как селективные модуляторы рецепторов глюкокортикоидов (SEGRM) обычно являются нестероидными . Комбинированное сокращение селективного агониста и модулятора рецептора глюкокортикоидов - SEGRAM . [2] Ряд таких лигандов был разработан и проходит доклинические и клинические испытания.
SEGRAM достигают своей селективности за счет запуска только части механизмов действия рецепторов глюкокортикоидов . [3] [4]
История [ править ]
Синтетические стероиды со свойствами, подобными SEGRA, были открыты еще в конце 1990-х годов. [5] В течение 2000-х годов было синтезировано много потенциальных SEGRAM, большинство из которых имеют нестероидные структуры. В исследованиях in vitro на клеточных моделях эти молекулы SEGRAM связываются с рецептором глюкокортикоидов со сродством, аналогичным дексаметазону , сильному глюкокортикоиду, и со способностью подавлять выработку медиаторов воспаления, таких как интерлейкин 6 и простагландин E2 . [6] Более того, in vitro конкретная SEGRAM может способствовать апоптозу при раке простаты [7] илейкоз . [8]
Исследования in vivo на мышах и крысах показали, что местно вводимый SEGRAM ингибировал активность пероксидазы и образование отека , оба показателя противовоспалительной активности, по сравнению с преднизолоном . Системное введение мышам или крысам показывает, что SEGRAM могут уменьшить острые инфекции , ревматоидный артрит , астму и колит . [2] In vivoДоказательства того, могут ли определенные SEGRAM вызывать эффекты, подобные классическим глюкокортикоидам при онкологических патологиях, в настоящее время отсутствуют. Текущие доклинические тесты показывают, что доступные до сих пор SEGRAM вызывают меньше побочных эффектов или, по крайней мере, менее серьезных побочных эффектов, чем классические глюкокортикоиды. [2] Например, атрофия кожи у крыс была значительно менее выражена, чем при приеме преднизолона в исследовании с использованием SEGRAM Mapracorat , а метаболические эффекты, такие как увеличение веса или повышение уровня глюкозы в крови, практически отсутствовали. [9]
Механизм действия [ править ]
Как неселективные глюкокортикоиды, так и селективные агонисты рецепторов глюкокортикоидов действуют путем связывания и активации рецептора глюкокортикоидов (GR). В отличие от глюкокортикоидов, которые активируют GR для прохождения (по крайней мере) двух путей передачи сигнала, [10] SEGRAM активируют GR таким образом, что он действует только через один из двух основных возможных путей. [11]
В отсутствие глюкокортикоидов GR находится в цитозоле в неактивном состоянии в комплексе с белками теплового шока (HSP) и иммунофилинами . Связывание глюкокортикоидов с GR активирует рецептор, вызывая конформационные изменения в GR и, таким образом, диссоциацию связанных HSP. Затем активированный GR может регулировать экспрессию генов одним из двух путей: [10]
- Трансактивация
- Первый (прямой) путь называется трансактивацией, при которой активированный GR димеризуется , перемещается в ядро и связывается со специфическими последовательностями ДНК, называемыми элементами ответа глюкокортикоидов (GRE). Комплекс GR / ДНК привлекает другие белки, которые транскрибируют нижележащую ДНК в мРНК и, в конечном итоге, в белок . Примеры генов, чувствительных к глюкокортикоидам, включают те, которые кодируют аннексин A1 , TSC22D3 (также известный как GILZ), ангиотензин-превращающий фермент , нейтральную эндопептидазу и другие противовоспалительные белки.
- Трансрепрессия
- Второй (непрямой) путь называется трансрепрессией , при которой активированный мономерный GR связывается с другими факторами транскрипции, такими как NF-κB и AP-1, и предотвращает активацию ими экспрессии их генов-мишеней. Эти гены-мишени кодируют белки, такие как циклооксигеназа , NO-синтаза , фосфолипаза А2 , фактор некроза опухоли , трансформирующий фактор роста бета , ICAM-1 и ряд других провоспалительных белков.
Следовательно, противовоспалительное действие глюкокортикоидов является результатом как трансактивации, так и трансрепрессии. Напротив, исследования на крысах и мышах показали, что большинство побочных эффектов глюкокортикоидов, таких как диабетогенная активность, остеопороз , а также атрофия кожи, в основном вызваны трансактивацией. [9] [12] [13] Селективный глюкокортикоид, который способен трансрепрессироваться без трансактивации, должен сохранять многие желательные терапевтические противовоспалительные эффекты и сводить к минимуму эти нежелательные побочные эффекты. [11]
Первоначальные доказательства того, что одной транспрессии может быть достаточно для противовоспалительного ответа, было предоставлено путем введения точечной мутации в GR мышей, которая препятствовала димеризации GR и связыванию с ДНК и тем самым блокировала трансактивацию. [14] [15] В то же время эта мутация не препятствовала трансрепрессии. Хотя GR необходим для выживания, эти мыши все еще жизнеспособны. [14] Однако, когда этих мышей лечили синтетическим глюкокортикоидом дексаметазоном, повышения уровня глюкозы не наблюдалось. Эти мыши, получавшие дексаметазон, были устойчивы к воспалительному стимулу. [15] Следовательно, эти мыши были чувствительны к противовоспалительным эффектам дексаметазона, но были устойчивы по крайней мере к некоторым из побочных эффектов.
Так же, как глюкокортикоиды, SEGRAM связываются и активируют GR. Однако, в отличие от глюкокортикоидов, SEGRAM избирательно активируют GR таким образом, что они дают улучшенный терапевтический эффект. Как правило, для конкретных заболеваний, связанных с воспалением, SEGRAM должны более сильно трансрепрессировать, чем трансактивировать, или, еще лучше, трансрепрессировать и не трансактивировать. Этот тип селективной активации GR должен приводить к меньшему количеству побочных эффектов, чем ожидаемые побочные эффекты, которые появляются при длительном лечении классическими глюкокортикоидами. [16]
Клинические испытания [ править ]
Фаза II клинических испытаний одного из соединений-кандидатов, мапракората (кодовые названия BOL-303242-X и ZK 245186 [17] ), началась летом 2009 года. Одно из них было двойным слепым исследованием по поиску доз мази против атопического дерматита, проведенным Intendis. , часть Bayer HealthCare Pharmaceuticals, специализирующаяся на дерматологии . [18] В ноябре 2010 года началось исследование фазы III по оценке офтальмологической суспензии для лечения воспаления после операции по удалению катаракты, проведенное Bausch & Lomb . [19]
Фаза II , испытание с другим диссоциируют глюкокортикоидных fosdagrocorat (PF-04171327) (сложный эфир фосфорной кислоты пролекарство из dagrocorat (PF-00251802) [20] [21] ) для лечения ревматоидного артрита была начата в 2011 году Pfizer . [22]
Результаты этих клинических испытаний еще не были обнародованы, и ни один SEGRAM еще не был одобрен для клинического использования.
Возможные приложения [ править ]
При хронических воспалительных заболеваниях, таких как атопический дерматит (кожа), ревматоидный артрит (суставы), ... побочные эффекты кортикостероидов являются проблематичными из-за необходимого длительного лечения. Таким образом, SEGRAM исследуются в качестве альтернативного местного лечения. Системное долгосрочное лечение воспалений кортикостероидами особенно склонно вызывать метаболические побочные эффекты, что делает разработку пероральных SEGRAM интересной целью. [23] Еще неизвестно, действительно ли селективные агонисты или модуляторы рецепторов вызывают значительно меньше побочных эффектов, чем классические кортикоиды в клинических применениях.
Благоприятные атрофические эффекты [ править ]
Следует отметить, что атрофические эффекты глюкокортикоидов не всегда являются недостатком. Это свойство используется при лечении гиперпролиферативных заболеваний, таких как псориаз. [24] SEGRAM, вероятно, будет менее эффективен в таких условиях. Недавние достижения показали, что первое стремление к полному разделению трансрепрессии и трансактивации GR с помощью SEGRAMs заслуживает рассмотрения, поскольку противовоспалительные гены, стимулируемые трансактивацией GR, такие как GILZ и DUSP1 , действительно играют важную роль. [25] [26] Тем не менее, более избирательный характер этих SEGRAM все же снизит количество GR-опосредованных побочных эффектов и заслуживает дальнейшего клинического тестирования.
Химия [ править ]
Ранние SEGRA были синтетическими стероидами. Примером может служить RU 24858, одно из первых опубликованных соединений этого типа. [5] Многие новые SEGRA имеют другую структуру, хотя сходство со стероидами все еще можно увидеть в таких молекулах, как бензопиранохинолин A 276575 или в производных октагидрофенантрен-2,7-диола. Было показано, что все эти соединения проявляют свойства SEGRA на клеточных или животных моделях. [3]
Мапракорат является одним из ряда трифторпропаноламинов и -амидов, которые имеют менее явно стероидоподобную структуру. Другими типичными примерами этой группы являются ZK 216348 [9] и 55D1E1. [4] Объемные бициклические ароматические заместители (R 1 и R 2 ) объясняют структурное сходство с кортикоидами. R конформация из асимметричного углерода атома , как представляется, важное значение для GR сродством. [9]
Список SEGRM [ править ]
- Дагрокорат (PF-00251802, PF-251802)
- Фосдагрокорат (ПФ-04171327, ПФ-4171327)
- Мапракорат (BOL-303242-X, ZK-245186)
См. Также [ править ]
| Викискладе есть медиафайлы, связанные с селективными агонистами рецепторов глюкокортикоидов . |
- Селективный модулятор рецепторов
- Селективный модулятор рецепторов андрогенов
- Селективный модулятор рецепторов эстрогена
- Селективный модулятор рецепторов прогестерона
Ссылки [ править ]
- ^ Мили N; Dulsat C (2009 г.). «36-е ежегодное собрание Arbeitsgemeinschaft Dermatologische Forschung (ADF)». Наркотики Fut . 34 (4): 341.
- ^ a b c d Сундаль Н., Брайдланс Дж., Либерт С., Де Босшер К., Бек И.М. (май 2015 г.). «Селективная модуляция рецепторов глюкокортикоидов: новые направления с нестероидными каркасами». Фармакология и терапия . 152 : 28–41. DOI : 10.1016 / j.pharmthera.2015.05.001 . PMID 25958032 .
- ^ a b c Робинсон Р.П., Бакбиндер Л., Хаугето А.И., Макнифф П.А., Миллхэм М.Л., Риз М.Р., Шефер Дж.Ф., Абрамов Ю.А., Борднер Дж., Шантиньи Ю.А., Кляйнман Е.Ф., Лэрд Е.Р., Морган Б.П., Мюррей Дж. MD, Yocum SA (март 2009 г.). «Аналоги октагидрофенантрен-2,7-диола как диссоциированные агонисты рецепторов глюкокортикоидов: открытие и ведущие исследования». Журнал медицинской химии . 52 (6): 1731–43. DOI : 10.1021 / jm801512v . PMID 19239259 .
- ^ a b Biggadike K, Boudjelal M, Clackers M, Coe DM, Demaine DA, Hardy GW, Humphreys D, Inglis GG, Johnston MJ, Jones HT, House D, Loiseau R, Needham D, Skone PA, Uings I, Veitch G , Weingarten GG, McLay IM, Macdonald SJ (декабрь 2007 г.). «Нестероидные агонисты глюкокортикоидов: тетрагидронафталины с альтернативными миметиками стероидного А-кольца, обладающие селективностью диссоциированной (трансрепрессии / трансактивации) эффективности». Журнал медицинской химии . 50 (26): 6519–34. DOI : 10.1021 / jm070778w . PMID 18038970 .
- ^ a b c Vayssière BM, Dupont S, Choquart A, Petit F, Garcia T, Marchandeau C, Gronemeyer H, Resche-Rigon M (август 1997 г.). «Синтетические глюкокортикоиды, диссоциирующие трансактивацию и трансрепрессию AP-1, проявляют противовоспалительную активность in vivo». Молекулярная эндокринология . 11 (9): 1245–55. DOI : 10,1210 / me.11.9.1245 . PMID 9259316 .
- ^ а б Лин К.В., Накане М., Сташко М., Фоллс Д., Кук Дж., Миллер Л., Хуанг Р., Тайри С., Майнер Дж. Н., Розен Дж., Ким П. Р., Коглан М. Дж., Картер Дж., Лейн BC (август 2002 г.). «Трансактивационные и репрессивные свойства нового лиганда нестероидного глюкокортикоидного рецептора 2,5-дигидро-9-гидрокси-10-метокси-2,2,4-триметил-5- (1-метилциклогексен-3-y1) -1H- [1] бензопирано [3,4-f] хинолин (A276575) и его четыре стереоизомера ». Молекулярная фармакология . 62 (2): 297–303. DOI : 10,1124 / mol.62.2.297 . PMID 12130681 .
- ^ Емельянов А, Czwornog Дж, Гера л, Джоши S, Чаттертон RT, Budunova I (июнь 2008). «Новое соединение фитомодулятора стероидных рецепторов А ингибирует рост и выживание клеток рака простаты» . Исследования рака . 68 (12): 4763–73. DOI : 10.1158 / 0008-5472.CAN-07-6104 . PMID 18559523 .
- ^ Лесовая Е.А., Емельянов А.Ю., Кирсанов К., Якубовская М.Г., Budunova IV (ноябрь 2011). «Противоопухолевый эффект лиганда нестероидного глюкокортикоидного рецептора CpdA на лейкозных клеточных линиях CEM и K562» (PDF) . Биохимия. Биохимия . 76 (11): 1242–52. DOI : 10.1134 / S000629791111006X . PMID 22117551 . S2CID 35234449 .
- ^ a b c d Schäcke H, Schottelius A, Döcke WD, Strehlke P, Jaroch S, Schmees N, Rehwinkel H, Hennekes H, Asadullah K (январь 2004 г.). «Диссоциация трансактивации от трансрепрессии селективным агонистом рецептора глюкокортикоидов приводит к разделению терапевтических эффектов от побочных эффектов» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (1): 227–32. Bibcode : 2004PNAS..101..227S . DOI : 10.1073 / pnas.0300372101 . PMC 314167 . PMID 14694204 .
- ^ a b Rhen T, Cidlowski JA (октябрь 2005 г.). «Противовоспалительное действие глюкокортикоидов - новые механизмы для старых лекарств». Медицинский журнал Новой Англии . 353 (16): 1711–23. DOI : 10.1056 / NEJMra050541 . PMID 16236742 .
- ^ a b Ньютон Р., Холден Н.С. (октябрь 2007 г.). «Разделение трансрепрессии и трансактивации: мучительный развод для рецептора глюкокортикоидов?». Молекулярная фармакология . 72 (4): 799–809. DOI : 10,1124 / mol.107.038794 . PMID 17622575 . S2CID 52803631 .
- ^ Heinemann A, Schuligoi R (2008). «Глюкокортикоид - сильнодействующий и умстриттен» [Глюкокортикоиды - сильнодействующие и противоречивые]. Österreichische Apothekerzeitung (на немецком языке). 62 (23).
- ^ Коглэн МДж, Якобсон ПБ, Лейн В, Накан М, Лин CW, Элмор SW, Ким PR, Luly JR, Картер GW, Тернер R, Тайри СМ, Х J, Элгорт М, Розен Дж, Miner Ю.Н. (май 2003 г.). «Новое противовоспалительное средство поддерживает эффективность глюкокортикоидов с уменьшением побочных эффектов». Молекулярная эндокринология . 17 (5): 860–9. DOI : 10.1210 / me.2002-0355 . PMID 12586843 .
- ^ a b Reichardt HM, Kaestner KH, Tuckermann J, Kretz O, Wessely O, Bock R, Gass P, Schmid W, Herrlich P, Angel P, Schütz G (май 1998 г.). «Связывание ДНК глюкокортикоидного рецептора не является необходимым для выживания». Cell . 93 (4): 531–41. DOI : 10.1016 / S0092-8674 (00) 81183-6 . PMID 9604929 . S2CID 6524157 .
- ^ a b Reichardt HM, Tronche F, Bauer A, Schütz G (2000). «Молекулярно-генетический анализ передачи сигналов глюкокортикоидов с использованием системы Cre / loxP». Биологическая химия . 381 (9–10): 961–4. DOI : 10.1515 / BC.2000.118 . PMID 11076028 . S2CID 37837380 .
- ^ Schäcke H, M Berger, Ревинкель H, Asadullah K (сентябрь 2007). «Селективные агонисты рецепторов глюкокортикоидов (SEGRA): новые лиганды с улучшенным терапевтическим индексом» (PDF) . Молекулярная и клеточная эндокринология . 275 (1-2): 109-17. DOI : 10.1016 / j.mce.2007.05.014 . PMID 17630119 . S2CID 46020217 .
- ^ Cavet ME, Harrington KL, Уорд KW, Чжан JZ (2010). «Мапракорат, новый селективный агонист рецепторов глюкокортикоидов, ингибирует гиперосмолярное высвобождение цитокинов и пути MAPK в эпителиальных клетках роговицы человека» . Молекулярное зрение . 16 : 1791–800. PMC 2932489 . PMID 20824100 .
- ^ Номер клинического испытания NCT00944632 для «Повышение дозы различных концентраций ZK 245186 при атопическом дерматите» на ClinicalTrials.gov
- ^ Номер клинического испытания NCT01230125 "Офтальмологическая суспензия Мапракорат для лечения воспаления глаз после операции по удалению катаракты" на ClinicalTrials.gov
- ^ Сток Т, Fleishaker D, Мукерджи, А, Ле В, Сюй Дж, Zeiher В (2009). «Оценка безопасности, фармакокинетики и фармакодинамики селективного модулятора глюкокортикоидных рецепторов (SGRM) у здоровых добровольцев» . Ревматоидный артрит . 60 (Дополнение 10): 420. doi : 10.1002 / art.25503 (неактивно 2021-01-17).CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: DOI неактивен с января 2021 года ( ссылка )
- ↑ Hu X, Du S, Tunca C, Braden T, Long KR, Lee J, Webb EG, Dietz JD, Hummert S, Rouw S, Hegde SG, Webber RK, Obukowicz MG (август 2011). «Антагонисты, но не частичные агонисты лигандов глюкокортикоидных рецепторов, проявляют существенный побочный эффект диссоциации». Эндокринология . 152 (8): 3123–34. DOI : 10.1210 / en.2010-1447 . PMID 21558312 .
- ^ Номер клинического испытания NCT01393639 "Исследование, сравнивающее дозы экспериментального глюкокортикоидного соединения с преднизоном и плацебо при ревматоидном артрите" на ClinicalTrials.gov
- ^ Schäcke Н, Hennekes Н, Schottelius А, Jaroch S, Леман М, Schmees Н, Ревинкель Н, Asadullah К (2002). «SEGRAs: новый класс противовоспалительных соединений». Семинар исследовательского фонда Эрнста Шеринга (40): 357–71. DOI : 10.1007 / 978-3-662-04660-9_20 . ISBN 978-3-662-04662-3. PMID 12355726 .
- ^ Kerscher МДж, Харт Н, Korting HC, Stalleicken D (апрель 1995 г.). «Оценка in vivo атрофогенного действия мометазона фуроата, недавно разработанного хлорированного сильнодействующего глюкокортикоида для местного применения по сравнению с другими старыми и новыми глюкокортикоидами для местного применения». Международный журнал клинической фармакологии и терапии . 33 (4): 187–9. PMID 7620686 .
- Перейти ↑ Shah S, King EM, Chandrasekhar A, Newton R (май 2014 г.). «Роли митоген-активируемой протеинкиназы (MAPK) фосфатазы, DUSP1, в контроле обратной связи экспрессии воспалительных генов и репрессии дексаметазоном» . Журнал биологической химии . 289 (19): 13667–79. DOI : 10.1074 / jbc.M113.540799 . PMC 4036371 . PMID 24692548 .
- ^ Ayroldi E, Macchiarulo A, C Риккарди (декабрь 2014). «Нацеленность на побочные эффекты глюкокортикоидов: селективный модулятор рецепторов глюкокортикоидов или лейциновая молния, индуцированная глюкокортикоидами? Перспектива». Журнал FASEB . 28 (12): 5055–70. DOI : 10.1096 / fj.14-254755 . PMID 25205742 . S2CID 40874311 .