 | |
| Имена | |
|---|---|
| Название ИЮПАК Динатрий фосфорофторидат | |
| Другие имена Фторфосфат натрия, монофторфосфат натрия | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.030.381 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
CompTox Dashboard ( EPA ) | |
| |
| |
| Характеристики | |
| Na 2 PFO 3 | |
| Молярная масса | 143,95 г / моль |
| Внешность | белый порошок |
| Температура плавления | 625 ° С (1157 ° F, 898 К) |
| 25 г / 100 мл | |
| Растворимость | не растворим в этаноле , эфире |
| Фармакология | |
| A01AA02 ( ВОЗ ) A12CD02 ( ВОЗ ) | |
| Опасности | |
| Паспорт безопасности | Сигма-Олдрич |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD 50 ( средняя доза ) | 502 мг / кг (крыса, перорально) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
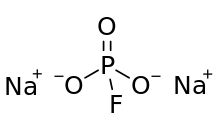
Монофторфосфат натрия , обычно сокращенно MFP , представляет собой неорганическое соединение с химической формулой Na 2 PO 3 F. Типичное для соли , MFP не имеет запаха, не имеет цвета и растворимо в воде. Эта соль входит в состав некоторых зубных паст . [1]
Использует [ редактировать ]
MFP наиболее известен как ингредиент некоторых зубных паст . [2] Он действует как источник фторида посредством следующей реакции гидролиза : [1]
- PO 3 F 2− + OH - → HPO 4 2− + F -
Фторид защищает зубную эмаль от нападения бактерий, вызывающих кариес ( кариес ). Хотя он был разработан химиком из Procter and Gamble , его использование в зубной пасте ( зубная паста Colgate и Ultra Brite ) было запатентовано компанией Colgate-Palmolive , поскольку Procter and Gamble занималась маркетингом зубной пасты Crest (содержащей фторид олова , продаваемой как «Флюористан»). ). В начале 1980-х Crest был переработан для использования MFP под торговой маркой «Fluoristat»; сегодня зубные пасты Crest используют фторид натрия или фторид олова. По сравнению с чистыми фторидами, монофторфосфат натрия имеет немного меньшее послевкусие.
MFP также используется в некоторых лекарствах для лечения остеопороза . [1]
В 1991 году компания Calgon обнаружила, что монофторфосфат натрия ингибирует растворение свинца в питьевой воде при использовании в концентрациях от 0,1 до 500 мг / л. [3]
Разрушение зубов [ править ]
Разрушение зубов вызывается бактериями, которые естественным образом присутствуют во рту. Эти бактерии образуют на зубах липкую бесцветную мягкую пленку, называемую налетом . Когда едят продукты, содержащие углеводы ( крахмал и сахар ), бактерии, образующие зубной налет, используют сахар как форму энергии. Они также превращают его в клейкое вещество, которое помогает им прилипать к поверхности зуба. Зубной налет выделяет кислоту , которая разрушает эмаль . [4]
Химия распада [ править ]
Эмаль зубов состоит в основном из гидроксифосфата кальция, Ca 5 (PO 4 ) 3 OH, также известного как минерал гидроксиапатит . Апатит - твердое нерастворимое соединение. Кислота (H + ), вырабатываемая особенно после еды с высоким содержанием сахара, атакует апатит:
- Ca 5 (PO 4 ) 3 OH (s) + H + (водн.) → Ca 5 (PO 4 ) 3 + (водн.) + H 2 O (ℓ)
Химия фторирования эмали [ править ]
Разложение апатита за счет потери ОН - вызывает растворение эмали. Этот процесс обратим, так как слюна возвращает ОН - для преобразования апатита. Если в слюне присутствуют ионы фтора, F - , образуется также фторапатит Ca 5 (PO 4 ) 3 F.
- Ca 5 (PO 4 ) 3 + (водн.) + F - (водн.) → Ca 5 (PO 4 ) 3 F (s)
Фторапатит лучше сопротивляется воздействию кислот, чем сам апатит, поэтому зубная эмаль противостоит разрушению лучше, чем эмаль, не содержащая фтора. [5]
Подготовка и структура [ править ]
Монофторфосфат натрия производится в промышленных масштабах реакцией фторида натрия с метафосфатом натрия : [1]
- NaPO 3 + NaF → Na 2 PO 3 F
Процесс включает разрыв пирофосфатной связи, аналогичный гидролизу. NaMFP также можно получить обработкой тетранатрийпирофосфата или динатрийфосфата фтористым водородом. [1]
В лаборатории МФП можно приготовить путем гидролиза дифторфосфат-ионов разбавленным гидроксидом натрия :
- PO 2 F 2 - + 2 NaOH → Na 2 PO 3 F + H 2 O + F -
Структура [ править ]
Структура фторфосфат-аниона состоит из фосфора в центре тетраэдра, образованного тремя атомами кислорода и одним фтором . Формальные представления изображают двойную связь между одним атомом кислорода и фосфора, с одинарными связями для двух других атомов кислорода и фтора. На этом очень формальном изображении отрицательный заряд локализован на атомах O одинарных связей PO. MFP аналогичен Na 2 SO 4 и изоэлектронен с ним . Анион имеет симметрию C 3v .
Открытие и развитие [ править ]
Монофторфосфат натрия был впервые описан в 1929 году немецким химиком Вилли Ланге , работавшим тогда в Берлинском университете. Его бесплодные попытки получить свободную монофторфосфорную кислоту заставили его проверить стабильность ее эфиров. Таким образом, вместе с Гердой фон Крюгер , одной из его учениц, Ланге синтезировал диэтилфторфосфат и некоторые аналоги, которые оказались весьма токсичными, поскольку относились к нервно-паралитическим агентам . В 1930-х годах Герхард Шрадер , работавший в немецкой компании IG Farben , пытался разработать синтетический инсектицид.. Его работа была сосредоточена на сложных эфирах фосфорной кислоты и привела к случайному открытию некоторых других нервно-паралитических агентов, таких как DFP ( диизопропилфторфосфат ), табун , зоман и зарин . Тем временем Ланге, который был женат на еврейке, эмигрировал из Германии в США и начал работать в компании Procter and Gamble . В 1947 году он и Ральф Ливингстон из Monsanto Company опубликовали препарат свободных фторфосфорных кислот и упомянули об использовании некоторых токсичных эфиров монофторфосфорной кислоты (например, DFP) при лечении глаукомы и миастении.. Хорошо известная токсичность этих сложных эфиров привела к опасениям, что простые соли также могут быть токсичными, и такие опасения исключали любое крупномасштабное коммерческое использование солей. В 1950 году при спонсорской поддержке производителя соединений, Ozark Chemical Company , токсичность монофторфосфата натрия была изучена Гарольдом Ходжем из Университета Рочестера, который включал в себя тестирование против кариеса. В 1967 году компания Colgate-Palmolive подала несколько патентов на использование монофторфосфата натрия в зубной пасте. [3]
Безопасность [ править ]
Обычное содержание МФП в зубной пасте составляет 0,76%. Это соединение используется вместо фторида натрия, особенно в детских зубных пастах, потому что оно менее токсично, хотя оба обладают умеренной токсичностью. LD 50 у крыс составляет 0,9 г / кг. [6]
Ссылки [ править ]
- ^ a b c d e Клаус Шредтер, Герхард Беттерманн, Томас Штаффель, Фридрих Валь, Томас Кляйн, Томас Хофманн «Фосфорная кислота и фосфаты» в Энциклопедии промышленной химии Ульмана 2008, Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a19_465.pub3
- ^ Вольфганг Вайнерт "Продукты гигиены полости рта" в Энциклопедии промышленной химии Ульмана 2000, Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a18_209
- ^ a b Питер Мейерс История монофторфосфата
- ^ «HealthyTeeth - Советы по здоровому сну, новости и обзоры продуктов» . HealthyTeeth . Проверено 19 апреля 2018 года .
- ^ Дэвис, Р. Э., доктор философии, Меткалф, ХК, Уильямс, Дж. Э., Кастка, Дж. Ф. (1999). Современная химия . Остин, Техас: Harcourt Brace & Company.
- ^ "Архивная копия" . Архивировано из оригинала на 2009-01-11 . Проверено 6 июля 2009 .CS1 maint: заархивированная копия как заголовок ( ссылка )
