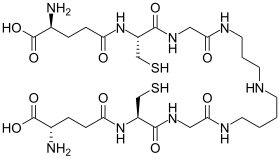
 | |
 Восстановленная форма (вверху) и окисленная форма (внизу) | |
| Имена | |
|---|---|
| Другие названия N1 , N8- бис (глутатионил) спермидин | |
| Идентификаторы | |
| |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
PubChem CID |
|
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 27 H 47 N 9 O 10 S 2 (окисленный) C 27 H 49 N 9 O 10 S 2 (восстановленный) | |
| Молярная масса | 721,84 г / моль (окисленный) 723,86 г / моль (восстановленный) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Трипанотион - это необычная форма глутатиона, содержащая две молекулы глутатиона, соединенные линкером спермидина ( полиамина ). Он содержится в паразитических простейших, таких как лейшмании и трипаносомы . [1] Эти простейшие паразиты являются причиной лейшманиоза , сонной болезни и болезни Шагаса . Трипанотион был открыт Аланом Фэрламбом . Его структура доказана химическим синтезом. [2] Он уникален для Kinetoplastida и не встречается у других паразитических простейших, таких как Entamoeba histolytica.. [3] Поскольку этот тиол отсутствует у людей и необходим для выживания паразитов, ферменты, которые производят и используют эту молекулу, являются мишенями для разработки новых лекарств для лечения этих заболеваний. [4]
Трипанотион-зависимые ферменты включают редуктазы , пероксидазы , глиоксалазы и трансферазы . Трипанотион-дисульфидредуктаза (TryR) была первым обнаруженным трипанотион-зависимым ферментом ( EC 1.8.1.12 ). Это НАДФН-зависимый флавоэнзим, который восстанавливает дисульфид трипанотиона. TryR необходим для выживания этих паразитов как in vitro, так и в организме человека-хозяина. [5] [6]
Основная функция трипанотиона - защита от окислительного стресса . [7] Здесь трипанотион-зависимые ферменты, такие как трипаредоксинпероксидаза ( TryP ), восстанавливают пероксиды с помощью электронов, переданных либо непосредственно из трипанотиона, либо через промежуточный окислительно-восстановительный трипаредоксин ( TryX ). Трипанотион-зависимый метаболизм перекиси водорода особенно важен для этих организмов, поскольку в них отсутствует каталаза . Поскольку трипаносоматиды также не имеют эквивалента тиоредоксинредуктазы , трипанотионредуктаза - единственный путь, по которому электроны могут пройти от НАДФН к этим антиоксидантным ферментам.
Ссылки [ править ]
- ^ Фэрлемб AH, Cerami A (1992). «Метаболизм и функции трипанотиона в кинетопластиде». Анну. Rev. Microbiol . 46 : 695–729. DOI : 10.1146 / annurev.mi.46.100192.003403 . PMID 1444271 .
- ^ Fairlamb, AH; Blackburn, P .; Ulrich, P .; Чайт, БТ; Керами, А. (март 1985 г.). «Трипанотион: новый кофактор бис (глутатионил) спермидина для глутатионредуктазы в трипаносоматидах». Наука . 227 (4693): 1485–1487. Bibcode : 1985Sci ... 227.1485F . DOI : 10.1126 / science.3883489 . ISSN 0036-8075 . PMID 3883489 .
- ^ Ariyanayagam MR, Фэрлемб AH (сентябрь 1999). «У Entamoeba histolytica отсутствует метаболизм трипанотиона». Мол. Биохим. Паразитол . 103 (1): 61–9. DOI : 10.1016 / S0166-6851 (99) 00118-8 . PMID 10514081 .
- ^ Schmidt A, Krauth-Siegel RL (ноябрь 2002). «Ферменты метаболизма трипанотиона как мишени для разработки антитрипаносомных препаратов» . Curr Top Med Chem . 2 (11): 1239–59. DOI : 10.2174 / 1568026023393048 . PMID 12171583 .
- ^ Tovar J, Вилкинсон S, Моттрам JC, Фэрлемб АГ (июль 1998 года). «Доказательства того, что трипанотионредуктаза является важным ферментом Leishmania путем целевой замены локуса гена tryA» . Мол. Microbiol . 29 (2): 653–60. DOI : 10.1046 / j.1365-2958.1998.00968.x . PMID 9720880 .
- ^ Кригер S, Шварц Вт, Ariyanayagam МР, Фэрлемб АГ, Krauth-Siegel RL, Clayton С (февраль 2000 г.). «Трипаносомы, в которых отсутствует трипанотионредуктаза, авирулентны и проявляют повышенную чувствительность к окислительному стрессу» . Мол. Microbiol . 35 (3): 542–52. DOI : 10.1046 / j.1365-2958.2000.01721.x . PMID 10672177 .
- ^ Krauth-Siegel RL, Meiering SK, Шмидт H (апрель 2003). «Паразитоспецифический метаболизм трипанотиона трипаносомы и лейшмании». Биол. Chem . 384 (4): 539–49. DOI : 10.1515 / BC.2003.062 . PMID 12751784 .