Асимметрия GC - это когда нуклеотидов гуанина и цитозина избыточно или недостаточно в определенной области ДНК или РНК . В условиях равновесия (без мутационного или селективного давления и со случайным распределением нуклеотидов в геноме ) четыре основания ДНК ( аденин , гуанин , тимин и цитозин ) имеют одинаковую частоту на обеих отдельных цепях молекулы ДНК. [1] Однако у большинства бактерий (например, E. coli) и некоторых архей (например, Sulfolobus solfataricus ), нуклеотидные составы асимметричны между ведущей цепью и отстающей цепью : ведущая цепь содержит больше гуанина (G) и тимина (T), тогда как отстающая цепь содержит больше аденина (A) и цитозина. (С). [1] Это явление называется перекосом GC и AT . Математически это представляется следующим образом: [2]
Наклон GC = (G - C) / (G + C)
AT перекос = (A - T) / (A + T)
Асимметричный нуклеотидный состав [ править ]
Работа Эрвина Чаргаффа в 1950 году продемонстрировала, что в ДНК основания гуанин и цитозин были обнаружены в равном количестве, а основания аденин и тимин были обнаружены в равном количестве. Однако не было равенства между количеством одной пары и другой. [3] Открытие Чаргаффа упоминается как правило Чаргаффа или правило четности 1 . [3] Три года спустя Уотсон и Крик использовали этот факт при выводе структуры ДНК, своей модели двойной спирали .
Естественным результатом правила четности 1 в состоянии равновесия, в котором нет смещений мутаций и / или отбора ни в одной из двух цепей ДНК, является то, что при равной скорости замен комплементарные нуклеотиды на каждой цепи имеют равные количества данной базы и ее дополнения. [4] Другими словами, в каждой цепи ДНК частота появления T равна A, а частота появления G равна C, поскольку частота замен предположительно одинакова. Это явление называется правилом четности 2 . Следовательно, второе правило четности существует только тогда, когда нет мутации или замены.
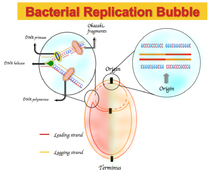
Любое отклонение от правила четности 2 приведет к асимметричному составу оснований, который отличает ведущую цепь, т. Е. Цепь ДНК, которая реплицируется в прямом направлении, от отстающей цепи. Эта асимметрия называется перекосом GC или AT. [1]
В некоторых бактериальных геномах наблюдается обогащение гуанином над цитозином и тимином над аденином в ведущей цепи и наоборот для отстающей цепи. Спектры асимметрии нуклеотидного состава варьируются от -1, что соответствует G = 0 или A = 0, до +1, что соответствует T = 0 или C = 0. [1] Следовательно, положительный сдвиг GC представляет собой богатство G над C а отрицательный перекос GC представляет собой насыщение C по сравнению с G. В результате ожидается увидеть положительный перекос GC и отрицательный перекос AT в ведущей цепи, а также отрицательный перекос GC и положительный перекос AT в отстающей цепи. [5] GC или AT skew изменяют знак на границах двух репликоров , которые соответствуют началу или концу репликации ДНК. [1] [4] [5]Первоначально этот асимметричный нуклеотидный состав объяснялся как другой механизм, используемый в репликации ДНК между ведущей цепью и отстающей цепью. Репликация ДНК - полуконсервативный и асимметричный процесс. [6] Эта асимметрия обусловлена образованием репликационной вилки и ее разделением на возникающие ведущие и отстающие нити. Ведущая цепь синтезируется непрерывно и рядом с ведущей цепью; Отстающая цепь реплицируется через короткие фрагменты полинуклеотида ( фрагменты Окадзаки ) в направлении от 5 'до 3'. [6]
Расчет и графики перекоса GC [ править ]
Существует три основных подхода к вычислению и графической демонстрации перекоса сборщика мусора и его свойств.
Асимметрия GC [ править ]
Первый подход - асимметрия GC и AT. [1] Жан Р. Лобри был первым, кто в 1996 году сообщил [7] о наличии композиционной асимметрии в геномах трех бактерий: E. coli , Bacillus subtilis и Haemophilus influenzae . Первоначальные формулы в то время назывались не перекосом, а скорее отклонением от [A] = [T] или [C] = [G]:
отклонение от [A] = [T] как (A - T) / (A + T);
отклонение от [C] = [G] как (C - G) / (C + G);
где A, T, G и C представляют частоту появления эквивалентного основания в конкретной последовательности определенной длины. Стратегия скольжения окна используется для вычисления отклонения от C по геному. На этих графиках положительное отклонение от C соответствует отстающей цепи, а отрицательное отклонение от C соответствует ведущей цепи. [8]Кроме того, место переключения знака отклонения соответствует исходной точке или конечной точке. Ось x представляет положения хромосом, нанесенные на график от 5 'до 3', а ось y представляет значение отклонения. Основным недостатком этого метода является его свойство, зависящее от размера окна. Следовательно, выбор соответствующего размера окна сильно влияет на результат построения графика. Другие методы должны сочетаться с отклонением, чтобы идентифицировать и локализовать источник репликации ДНК с большей точностью.
CGC перекос [ править ]
Второй подход называется кумулятивным перекосом сборки мусора (CGC skew). [2] В этом методе по-прежнему используется стратегия скользящего окна, но при этом используется сумма соседних окон с произвольного начала. В этой схеме весь геном обычно нанесен на 5 '- 3' с использованием произвольного начала и произвольной цепи. На кумулятивном графике перекоса GC пики соответствуют точкам переключения (конечная точка или начало координат).
В отличие от более ранней статьи Лобри, недавние реализации GC skew переворачивают исходное определение, переопределяя его следующим образом:
GC перекос = (G - C) / (G + C).
При перевернутом определении перекоса GC максимальное значение кумулятивного перекоса соответствует окончанию, а минимальное значение соответствует началу репликации.
Кривая Z [ править ]
Окончательный подход является кривой Z . [9] В отличие от предыдущих методов, этот метод не использует стратегию скользящего окна и считается более эффективным в поиске источника репликации. [9] В этом методе исследуется кумулятивная частота каждой базы по отношению к базе в начале последовательности. Кривая Z использует трехмерное представление со следующими параметрами:
Где , представляет собой избыток пурина над пиримидином, обозначает избыток кето над амино и показывает взаимосвязь между слабыми и сильными водородными связями . и только компоненты могут определять начало репликации и асимметричный состав цепей. Комбинация этих методов должна использоваться для прогнозирования начала и окончания репликации, чтобы компенсировать их слабость.
Механизм [ править ]
В научном сообществе отсутствует консенсус относительно механизма, лежащего в основе смещения нуклеотидного состава в каждой цепи ДНК. Существуют две основные школы мысли, которые объясняют механизм, лежащий в основе специфического нуклеотидного состава цепи у бактерий. [4]
Первый описывает смещение и асимметричное мутационное давление на каждую нить ДНК во время репликации и транскрипции . [4] [10] Из-за асимметричной природы процесса репликации, неравная частота мутаций и эффективность репарации ДНК во время процесса репликации могут привести к большему количеству мутаций в одной цепи по сравнению с другой. [5] Кроме того, время, используемое для репликации между двумя цепями, варьируется и может привести к асимметричному мутационному давлению между ведущей и отстающей цепью. [11] Помимо мутаций во время репликации ДНК, транскрипционные мутации могут создавать перекос нуклеотидного состава цепи.[5] Дезаминирование цитозина и, в конечном итоге, мутация цитозина в тимин в одной цепи ДНК может увеличить относительное количество гуанина и тимина по отношению к цитозину и аденину. [5] У большинства бактерий большинство генов кодируется ведущей цепью. [4] Например, ведущая цепь Bacillus subtilis кодирует 75% генов. [5] Кроме того, сообщалось об избытке дезаминирования и превращения цитозина в тимин в кодирующей цепи по сравнению с некодирующей цепью. [4] [5] [12] Одно из возможных объяснений состоит в том, что нетранскрибируемая цепь ( кодирующая цепь) является одноцепочечным в процессе транскрипции; следовательно, он более уязвим для дезаминирования по сравнению с транскрибируемой цепью ( некодирующей цепью ). [5] [13] Другое объяснение состоит в том, что активность репарации дезаминирования во время транскрипции не проявляется в кодирующей цепи. [5] Только транскрибированная нить извлекает выгоду из этих событий репарации дезаминирования.
Вторая школа мысли описывает механизм перекоса GC и AT как результат разницы в давлении отбора между ведущими и отстающими нитями. [4] [5] [13] Исследование прокариотического генома показывает предпочтение в положении третьего кодона для G по сравнению с C и T по сравнению с A. [5] Это различение создает асимметричный нуклеотидный состав, если кодирующая цепь неравномерно распределена между ведущие и отстающие нити, как в случае с бактериями. Кроме того, было показано , что гены с высокой степенью транскрибирования, такие как рибосомные белки , расположены в основном на ведущей цепи бактерий. [5]Следовательно, смещение в выборе кодона G в третьем положении по сравнению с C может привести к смещению GC. Кроме того, некоторые сигнальные последовательности богаты гуанином и тимином, такие как последовательности chi , и эти последовательности могут иметь более высокую частоту встречаемости в одной цепи по сравнению с другой. [4] [5]
Как мутационное, так и селективное давление могут независимо вносить асимметрию в цепи ДНК. Однако комбинация и кумулятивный эффект обоих механизмов является наиболее вероятным объяснением перекоса GC и AT. [4] [13]
Использует [ редактировать ]
Доказано, что перекос GC является полезным индикатором ведущей цепи ДНК, отстающей цепи, точки начала репликации и конца репликации. [1] [4] [5] Большинство бактерий и архей содержат только одну точку начала репликации ДНК. [1] Асимметрия GC положительна и отрицательна в ведущей цепи и в отстающей цепи соответственно; поэтому ожидается, что изменение знака перекоса GC будет только в точке начала и конца репликации ДНК. [4] GC перекос также может быть использован для изучения смещения цепей и механизма, связанного с ними, путем вычисления превышения одного основания над его дополнительным основанием в различных средах. [4] [5] [13] Такие методы, как перекос GC, перекос CGC и кривая Z, являются инструментами, которые могут дать возможность лучше изучить механизм репликации ДНК в различных организмах.
Ссылки [ править ]
- ^ a b c d e f g h Лобри, Дж. Р. Асимметричные схемы замещения в двух цепях ДНК бактерий. Молекулярная биология и эволюция 13, 660-665 (1996).
- ^ a b Григорьев А. Анализ геномов с кумулятивными перекосами. Nucleic Acids Research 26, 2286-2290 (1998).
- ^ a b Chargaff, E. Химическая специфичность нуклеиновых кислот и механизм их ферментативной деградации. Experientia 6, 201-209 (1950).
- ^ a b c d e f g h i j k l Necsulea, A. & Lobry, JR Новый метод оценки влияния репликации на асимметрию состава оснований ДНК. Молекулярная биология и эволюция 24, 2169-2179, DOI: 10.1093 / molbev / msm148 (2007).
- ^ a b c d e f g h i j k l m n o Tillier, ER & Collins, RA Вклад ориентации репликации, направления генов и сигнальных последовательностей в асимметрию базового состава в бактериальных геномах. Журнал молекулярной эволюции 50, 249-257 (2000).
- ^ a b Роча, Е.П. Организация бактериальных геномов, связанная с репликацией. Microbiology 150, 1609-1627, DOI: 10.1099 / mic.0.26974-0 (2004).
- ^ Lobry, JR (май 1996). «Асимметричные схемы замещения в двух нитях ДНК бактерий» . Молекулярная биология и эволюция . 13 (5): 660–665. DOI : 10.1093 / oxfordjournals.molbev.a025626 . ISSN 0737-4038 . PMID 8676740 .
- ^ "Объяснение статьи Лобри 1996 г."
- ^ a b Zhang, R. & Zhang, CT Множественные источники репликации архей Halobacterium разновидностей NRC-1. Сообщения о биохимических и биофизических исследованиях 302, 728-734 (2003).
- ^ Lobry, JR & Sueoka, N. Асимметричные направленные мутации давления в бактериях. Геномная биология 3, RESEARCH0058 (2002).
- ^ Эппингер, М., Баар, К., Раддац, Г., Хьюсон, Д.Х. и Шустер, С.К. Сравнительный анализ четырех Campylobacterales. Обзоры природы. Microbiology 2, 872-885, DOI: 10.1038 / nrmicro1024 (2004).
- ^ Marin, A. & Xia, X. GC перекос в генах, кодирующих белок, между ведущей и отстающей цепями в бактериальных геномах: новые модели замещения, включающие перекос цепей. Журнал теоретической биологии 253, 508-513, DOI: 10.1016 / j.jtbi.2008.04.004 (2008).
- ^ a b c d Чарнески К.А., Хонти Ф., Брайант Дж. М., Херст Л. Д., Фейл Э. Дж. Атипичный перекос AT в устойчивых геномах - результат отбора, а не мутации. PLoS Genetics 7 (9): e1002283 (2011).
- Mewes, HW et al. MIPS: анализ и аннотация белков из полных геномов в 2005 г. Nucleic Acids Res 34, D169-172, DOI: 10.1093 / nar / gkj148 (2006).