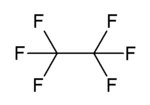
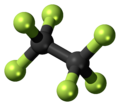
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гексафторэтан | |||
| Другие имена Гексафторид углерода, 1,1,1,2,2,2-гексафторэтан, перфторэтан, этфоран, галоген 116, PFC-116, CFC-116, R-116, Arcton 116, галон 2600, ООН 2193 | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.855 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| С 2 Ж 6 | |||
| Молярная масса | 138.01 г / моль -1 | ||
| Внешность | Бесцветный газ без запаха | ||
| Плотность | 5,734 кг · м −3 при 24 ° C | ||
| Температура плавления | -100,6 ° С (-149,1 ° F, 172,6 К) | ||
| Точка кипения | -78,2 ° С (-108,8 ° F, 195,0 К) | ||
| 0,0015% | |||
| журнал P | 2 | ||
Константа закона Генри ( k H ) | 0,000058 моль.кг -1 .бар -1 | ||
| Опасности | |||
| Паспорт безопасности | См .: страницу данных | ||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Негорючий | ||
| Страница дополнительных данных | |||
| Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | |||
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ , ИК , ЯМР , МС | |||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Гексафторэтан является перфторуглеродным аналогом углеводородного этана . Это негорючий газ, практически не растворимый в воде и мало растворимый в спирте . Это чрезвычайно мощный и долгоживущий парниковый газ .
Физические свойства [ править ]
Гексафторэтане в твердой фазе имеет две полиморфные . В научной литературе указываются разные температуры фазовых переходов . Последние работы определяют его при 103 К (-170 ° C). Ниже 103 К он имеет слегка неупорядоченную структуру, а над точкой перехода - объемноцентрированную кубическую структуру. [1] Критическая точка составляет 19,89 ° C (293,04 K) и 30,39 бар. [2]
Таблица плотностей:
| Состояние, температура | Плотность (кг.м −3 ) |
|---|---|
| жидкость, −78,2 ° C | 16.08 |
| газ, −78,2 ° C | 8,86 |
| газ, 15 ° C | 5,84 |
| газ, 20,1 ° C | 5,716 |
| газ, 24 ° C | 5,734 |
Плотность пара составляет 4,823 (воздух = 1), удельный вес при 21 ° C составляет 4,773 (воздух = 1), а удельный объем при 21 ° C составляет 0,1748 м 3 / кг.
Использует [ редактировать ]
Гексафторэтан используется в качестве универсального травителя при производстве полупроводников . Его можно использовать для селективного травления силицидов и оксидов металлов по сравнению с их металлическими подложками, а также для травления диоксида кремния над кремнием . Производство первичного алюминия и полупроводников является основными источниками выбросов гексафторэтана с использованием процесса Холла-Эру .
Вместе с трифторметаном он используется в хладагентах R508A (61%) и R508B (54%).
Воздействие на окружающую среду [ править ]
Из-за высокой энергии связей CF, гексафторэтан почти инертен и, таким образом, действует как чрезвычайно стабильный парниковый газ со сроком службы в атмосфере 10 000 лет (другие источники: 500 лет). [3] Он имеет потенциал глобального потепления (GWP) 9200 и озоноразрушающий потенциал (ODP) 0. Гексафторэтан включен в список парниковых газов МГЭИК .
Гексафторэтан не существовал в значительных количествах в окружающей среде до промышленного производства. В начале 21 века атмосферная концентрация гексафторэтана достигла 3 pptv. [4] Его полосы поглощения в инфракрасной части спектра вызывают радиационное воздействие примерно 0,001 Вт / м 2 .
Риски для здоровья [ править ]
Из-за своей высокой относительной плотности он скапливается в низинах, а при высоких концентрациях может вызвать удушье . Другие эффекты для здоровья аналогичны тетрафторметану .
См. Также [ править ]
- Фторуглерод , Перфторуглерод
- Тетрафторметан
- Октафторпропан
- Этан
- Тетрафторэтен
- Гексахлорэтан
Ссылки [ править ]
- ^ Цзэн, SX; Симмонс, РО; Тиммс, DN; Эванс, AC (1999). «Динамика и структура твердого гексафторэтана». Журнал химической физики . 110 (3): 1650–61. Bibcode : 1999JChPh.110.1650Z . DOI : 10.1063 / 1.477806 .
- ^ Helmut Schan: Handbuch дер reinsten Гаса. Springer, 2005, ISBN 978-3-540-23215-5 , S. 307.
- ^ "Перфторэтан CASRN: 76-16-4" . Сеть токсикологических данных TOXNET . Национальная медицинская библиотека. 2016-10-25.
- ^ «Изменение климата 2001: научная основа» . Архивировано из оригинала на 2007-06-15 . Проверено 2 июня 2007 .
- Бозин С.Е. и соавт. (1968). «Рост ионизационных токов в четырехфтористом углероде и гексафторэтане». J. Phys. D: Прил. Phys . 1 (3): 327–334. Bibcode : 1968JPhD .... 1..327B . DOI : 10.1088 / 0022-3727 / 1/3/309 .
Внешние ссылки [ править ]
- Процесс очистки гексафторэтана
- Протокол измерения тетрафторметана и гексафторэтана при производстве первичного алюминия
- Де Мар, GR; Панченко, Ю. Н. (март 2006 г.). «Ab initio колебательный анализ гексафторэтана C 2 F 6 ». Журнал структурной химии . 47 (2): 232–240. DOI : 10.1007 / s10947-006-0291-у .
- Протокол измерения тетрафторметана ( CF4) и гексафторэтан ( C2F6) Выбросы от производства первичного алюминия
- Таблица данных термохимии на сайте chemnet.ru