| Иммуномодулирующий имидный препарат | |
|---|---|
| Класс препарата | |
 Талидомид | |
| Идентификаторы класса | |
| Использовать | Узловатая лепрозная эритема , множественная миелома , миелодиспластический синдром , острый миелоидный лейкоз и другие иммунологические состояния |
| Код УВД | L04AX |
| Биологическая мишень | TNF , IL-6 , VEGF , NF-kB и др. |
| Клинические данные | |
| Drugs.com | Классы наркотиков |
| В Викиданных | |
Иммуномодулирующие имидные препараты ( IMiD ) - это класс иммуномодулирующих препаратов [1] (препаратов, регулирующих иммунные ответы ), содержащих имидную группу. Класс IMiD включает талидомид и его аналоги ( леналидомид , помалидомид , ибердомид и апремиласт ). [1] Эти препараты могут также называться «модуляторами цереблона». Цереблон - это белок, на который нацелены препараты этого класса.
Название «IMiD» относится как к «IMD» , что означает «иммуномодулирующее лекарство», так и к формам имида , имидо , имида и имида .
Разработка аналогов талидомида была ускорена открытием антиангиогенных и противовоспалительных свойств препарата, что привело к появлению нового способа борьбы с раком, а также с некоторыми воспалительными заболеваниями после того, как оно было запрещено в 1961 году. Проблемы с талидомидом включали ; тератогенные побочные эффекты, высокая частота других побочных реакций, плохая растворимость в воде и плохое всасывание из кишечника.
В 1998 году талидомид был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для применения при впервые выявленной множественной миеломе (ММ) в соответствии со строгими правилами. [2] Это привело к разработке ряда аналогов с меньшим количеством побочных эффектов и повышенной эффективностью, включая леналидомид , помалидомид и апремиласт , все из которых в настоящее время продаются и производятся компанией Celgene .
Поколения [ править ]
Существует три поколения IMiD, каждое последующее поколение лучше переносится и более активно против воспалительных и злокачественных заболеваний. [1]
- Первое поколение - талидомид
- Второе поколение - леналидомид и помалидомид
- Третье поколение - апремиласт
История [ править ]
Талидомид был первоначально выпущен в Федеративной Республике Германии (Западная Германия) под маркой Contergan 1 октября 1957 года компанией Chemie Grünenthal (ныне Grünenthal ). Препарат в основном назначали как успокаивающее или снотворное, но его также использовали как противорвотное средство при утреннем недомогании у беременных женщин. Препарат был запрещен в 1961 году после того, как были обнаружены его тератогенные свойства. Проблемы с талидомидом заключались, помимо тератогенных побочных эффектов, в высокой частоте других побочных реакций наряду с плохой растворимостью в воде и абсорбцией изкишечник . [3] [4] Побочные реакции включают периферическую невропатию у подавляющего большинства пациентов, запоры , тромбоэмболию и дерматологические осложнения. [5]
Спустя четыре года после того, как талидомид был снят с продажи из-за его способности вызывать серьезные врожденные дефекты, его противовоспалительные свойства были обнаружены, когда пациенты, страдающие узловатой лепрозной эритемой (ENL), использовали талидомид в качестве седативного средства, и это уменьшало как клинические признаки, так и симптомы болезнь. В 1991 г. было обнаружено, что талидомид ингибирует фактор некроза опухоли-альфа (TNF-α) (5a Sampaio, Sarno, Galilly Cohn and Kaplan, JEM 173 (3) 699-703, 1991). TNF-α - цитокин, продуцируемый макрофагами.иммунной системы, а также медиатор воспалительного ответа. Таким образом, препарат эффективен против некоторых воспалительных заболеваний, таких как ENL (6a Sampaio, Kaplan, Miranda, Nery ..... JID 168 (2) 408-414 2008). В 1994 г. было обнаружено, что талидомид обладает антиангиогенной активностью [6] и противоопухолевой активностью [7], что послужило толчком для начала клинических испытаний рака, включая множественную миелому. Открытие противовоспалительной, антиангиогенной и противоопухолевой активности талидомида повысило интерес к дальнейшим исследованиям и синтезу более безопасных аналогов. [8] [9]
Леналидомид - это первый аналог талидомида, который поступил на рынок. Он значительно более эффективен, чем его исходное лекарство, только с двумя различиями на молекулярном уровне, с добавленной аминогруппой в положении 4 фталоильного кольца и удалением карбонильной группы из фталоильного кольца. [10] Разработка леналидомида началась в конце 1990-х годов, а клинические испытания леналидомида начались в 2000 году. В октябре 2001 года леналидомид получил статус сирот для лечения ММ. В середине 2002 г. он перешел в фазу II, а к началу 2003 г. - в фазу III. В феврале 2003 г. FDA предоставило леналидомиду ускоренный статус для лечения рецидивирующего или рефрактерного ММ. [8] В 2006 г. он был одобрен для лечения ММ вместе с дексаметазоном, а в 2007 г.Европейское агентство по лекарственным средствам (EMA). В 2008 году в ходе исследования фазы II была выявлена эффективность лечения неходжкинской лимфомы . [11]
Помалидомид (3-аминоталидомид) был вторым аналогом талидомида, поступившим в клинику, будучи более мощным, чем оба его предшественника. [12] Впервые сообщалось в 2001 году, что помалидомид напрямую ингибирует пролиферацию миеломных клеток и, таким образом, ингибирует ММ как в опухоли, так и в сосудистых отделах. [13] Эта двойная активность помалидомида делает его более эффективным, чем талидомид, как in vitro, так и in vivo . [14] Этот эффект не связан с ингибированием TNF-α, поскольку сильнодействующие ингибиторы TNF-α, такие как ролипрам и пентоксифиллин, не ингибируют ни рост миеломных клеток, ни ангиогенез. [9] Сообщалось о повышении регуляции интерферона гамма, ИЛ-2 и ИЛ-10 для помалидомида, что может способствовать его антиангиогенной и противомиеломной активности.
Развитие [ править ]
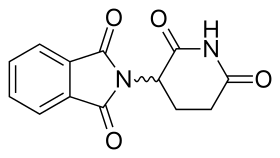
Молекула талидомида представляет собой синтетическое производное глутаминовой кислоты и состоит из глутаримидного кольца и фталоильного кольца (рис. 5). [15] [16] Его название по ИЮПАК - 2- (2,6-диоксопиперидин-3-ил) изоиндол-1,3-дион, и он имеет один хиральный центр. [15] После того, как было сообщено о селективном ингибировании талидомидом TNF-α , новые усилия были приложены к клинической разработке талидомида. Клиническая разработка привела к открытию новых аналогов, направленных на улучшение активности и уменьшение побочных эффектов. [8] [17]
Клинически талидомид всегда использовался как рацемат . Обычно S - изомер связан с печально известным тератогенным действием талидомида, а R- изомер лишен тератогенных свойств, но обладает седативным действием [8], однако эта точка зрения широко обсуждается, и утверждается, что модель на животных эти различные R- и S- эффекты наблюдались при нечувствительности к тератогенным эффектам талидомида. Более поздние сообщения о кроликах, которые являются чувствительным видом, выявили тератогенные эффекты обоих изомеров. [8] [15] [16] [17]Более того, энантиомеры талидомида, как было показано, взаимно превращаются in vivo из-за кислого хирального водорода в асимметричном центре (показано для аналога ЕМ-12 на Фигуре 3) [16] [17], так что план введения очищенного единственный энантиомер во избежание тератогенных эффектов, скорее всего, будет напрасным. [8] [15] [16]
Разработка леналидомида и помалидомида [ править ]
Один из интересующих аналогов представляет собой изоиндолиноновое замещение фталоильного кольца. Ему было присвоено название ЭМ-12 (рисунок 3). Считалось, что эта замена увеличивает биодоступность вещества из-за повышенной стабильности. Сообщалось, что эта молекула является даже более сильным тератогенным агентом, чем талидомид, для крыс, кроликов и обезьян. Кроме того, эти аналоги являются более сильными ингибиторами ангиогенеза, чем талидомид. [13] Кроме того, амино-талидомид и амино-ЕМ-12 были мощными ингибиторами TNF-α. [16] Эти два аналога позже получили название леналидомид, который является амино аналогом ЕМ-12, и помалидомид, амино аналог талидомида. [8]
Разработка апремиласта [ править ]
После обнаружения нового набора аналогов талидомида, а именно 3- (1,3-диоксо-1,3-дигидроизоиндол-2-ил) -3- (3,4-диметоксифенил) пропионовой кислоты (не показана), которые ингибировали PDE4 деятельность началась работа по оптимизации деятельности. Для этой цели исследователи использовали известную структурную составляющую , 3,4-диалкоксифенил, которая является признанным фармакофором в ингибиторах PDE4, таких как ролипрам (рис. 6) и рофлумиласт.и добавил его в структуру ранее упомянутой аналоговой серии. После настройки структуры и тестирования различных замен в положении 4 фталоильного кольца и карбоксильной кислоты исследователи наконец обнаружили молекулу, которая эффективно ингибирует PDE4 и TNF-α, которую они позже назвали апремиластом (рис. 4). S -энантиомера апремиласт был выбран , так как он был более активный энантиомер. [15] Поскольку в структуре апремиласта отсутствует кислотный хиральный водород, он не должен рацемизироваться in vivo , в отличие от талидомида, леналидомида и помалидомида. [16] [17]
Медицинское использование [ править ]
В первую очередь IMiD используются в медицине для лечения рака и аутоиммунных заболеваний (включая то, что является ответом на инфекционную лепру ). [18] Показания к применению этих агентов, получивших одобрение регулирующих органов, включают: [19]
- Миелодиспластический синдром , предшествующее острому миелоидному лейкозу
- Узловатая эритема , осложнение проказы
- Множественная миелома
Показания не по назначению, при которых они кажутся многообещающими методами лечения, включают: [20]
- Лимфома Ходжкина
- Амилоидоз, связанный с легкими цепями (AL)
- Первичный миелофиброз (ПМФ)
- Острый миелоидный лейкоз (ОМЛ)
- Рак простаты
- Метастатический почечно-клеточный рак (мПКР)
Талидомид [ править ]
Талидомид был одобрен FDA для ЭНЛ и ММ в сочетании с дексаметазоном . EMA также одобрило его для лечения ММ в сочетании с преднизоном и / или мелфаланом . Показания для сирот со стороны FDA включают болезнь трансплантат против хозяина , микобактериальную инфекцию, рецидивирующие афтозные язвы , тяжелый рецидивирующий афтозный стоматит , первичные злокачественные новообразования головного мозга, СПИД-ассоциированный синдром истощения , болезнь Крона , саркому Капоши , миелодиспластический синдром и трансплантацию гемопоэтических стволовых клеток . [21] [22]
Леналидомид [ править ]
Леналидомид одобрен почти в 70 странах в комбинации с дексаметазоном для лечения пациентов с ММ, которые ранее получали хотя бы одну терапию. Показания для сирот включают диффузную В-крупноклеточную лимфому , хронический лимфоцитарный лейкоз и лимфому из мантийных клеток . Леналидомид также одобрен для лечения трансфузионно-зависимой анемии из-за миелодиспластических синдромов низкого или среднего риска 1, связанных с цитогенетической аномалией делеции 5q с дополнительными цитогенетическими аномалиями или без них в США, Канаде, Швейцарии, Австралии, Новой Зеландии, Малайзии, Израиле и других странах. несколько стран Латинской Америки, при этом заявка на регистрациюв настоящее время оценивается в ряде других стран. [23] [24] Многочисленные клинические испытания уже находятся в стадии разработки или проводятся для изучения дальнейшего использования леналидомида, отдельно или в комбинации с другими лекарствами. Некоторые из этих показаний включают острый миелоидный лейкоз , фолликулярную лимфому , лимфому MALT , макроглобулинемию Вальденстрема , красную волчанку , лимфому Ходжкина , миелодиспластический синдром и многое другое. [25] [26]
Помалидомид [ править ]
Помалидомид был представлен на одобрение FDA 26 апреля 2012 г. [27], а 21 июня было объявлено, что препарат пройдет стандартную проверку FDA. Заявка на регистрацию сбыта была подана в EMA 21 июня 2012 года, решение по которой могло быть принято уже в начале 2013 года. EMA уже присвоило помалидомиду статус сиротства при первичном миелофиброзе , MM, системном склерозе , постполицитемии и пост-эссенциальном миелофиброзе тромбоцитемии. [28]
Апремиласт [ править ]
По состоянию на сентябрь 2012 г. апремиласт находится в фазе III испытаний на псориаз и в фазе II испытаний на ревматоидный артрит . Также исследуется эффективность при анкилозирующем спондилите . [29] По состоянию на март 2014 г. апремиласт был одобрен для лечения псориатического артрита. [30] В сентябре 2014 года FDA США одобрило апремиласт для лечения бляшечного псориаза средней и тяжелой степени.
Побочные эффекты [ править ]
Основными токсическими эффектами одобренных IMiD являются периферическая нейропатия , тромбоцитопения , анемия и венозная тромбоэмболия . [20] Может быть повышенный риск вторичных злокачественных новообразований, особенно острого миелоидного лейкоза у тех, кто получает IMiD. [20]
Тератогенность [ править ]
Тератогенность талидомида была предметом многочисленных споров, и на протяжении многих лет было предложено множество гипотез . Двумя наиболее известными из них были гипотеза антиангиогенеза и гипотеза модели окислительного стресса, со значительными экспериментальными данными, подтверждающими эти две гипотезы относительно тератогенности талидомида. [31]
Недавно появились новые открытия, которые предполагают новый механизм тератогенности. Cereblon является 51 к Да белок локализован в цитоплазме , ядре и периферической мембраны клеток в многочисленных частях тела. [32] Он действует как компонент убиквитинлигазы E3 , регулируя различные процессы развития, включая эмбриогенез , канцерогенез и регуляцию клеточного цикла, посредством деградации ( убиквитинирования).) неизвестных субстратов. Было показано, что талидомид связывается с церблоном, ингибируя активность убиквитинлигазы Е3, что приводит к накоплению субстратов лигазы и подавлению фактора роста фибробластов 8 (FGF8) и FGF10 . Это нарушает положительную обратную связь между двумя факторами роста, что может вызвать как множественные врожденные дефекты, так и противомиеломные эффекты.
Полученные данные также подтверждают гипотезу о том, что увеличение экспрессии церблона является важным элементом противомиеломного эффекта как леналидомида, так и помалидомида. [31] Экспрессия цереблонов была в три раза выше у пациентов, ответивших на лечение, по сравнению с пациентами, не отвечающими на лечение, и более высокая экспрессия цереблонов была также связана с частичным или полным ответом, тогда как более низкая экспрессия была связана со стабильным или прогрессирующим заболеванием. [32]
Механизм действия [ править ]
Их механизм действия не совсем ясен, но известно, что они подавляют выработку фактора некроза опухоли , интерлейкина 6 и иммуноглобулина G и VEGF (что приводит к его антиангиогенным эффектам), костимулируют Т-клетки и NK-клетки и увеличивает выработку интерферона гамма и интерлейкина 2 . [33] [34] [35] Их тератогенные эффекты, по-видимому, опосредованы связыванием с церблоном . [36] Апремиласт, с другой стороны, ингибирует PDE4 . [20]
Считается, что талидомид и его аналоги, леналидомид и помалидомид, действуют аналогичным образом, хотя их точный механизм действия еще полностью не изучен. Считается, что при различных заболеваниях они действуют через разные механизмы. Чистый эффект, вероятно, связан с сочетанием разных механизмов. Однако считается, что апремиласт действует через другой механизм и поэтому будет обсуждаться отдельно. Механизм действия будет объяснен в свете сегодняшних знаний, в основном, в MM (Рисунок 2).
Талидомид, леналидомид и помалидомид [ править ]
Изменение производства цитокинов [ править ]
Талидомид и его иммуномодулирующие аналоги изменяют продукцию воспалительных цитокинов TNF-α, IL-1 , IL-6 , IL-12 и противовоспалительного цитокина IL-10 . [32] Считается, что аналоги подавляют выработку TNF-α, причем аналоги в пробирке в 50 000 раз сильнее, чем исходное лекарственное средство талидомид. [37] Предполагается, что этот механизм связан с усилением деградации мРНК TNF-α , что приводит к уменьшению количества секретируемого провоспалительного цитокина. [38]Это объясняет эффект талидомида при назначении пациентам с ЭНЛ, поскольку у них обычно наблюдается высокий уровень TNF-α в крови и при дерматологических поражениях. [8] Напротив, анализ in vitro продемонстрировал, что TNF-α фактически усиливается при активации Т-клеток, где CD4 + и CD8 + Т-лимфоциты стимулировались анти-CD3 [8] [37], что позже было подтверждено в ранней фазе испытаний. вовлекающие солидные опухоли и воспалительные дерматологические заболевания. [38] ИЛ-12 - еще один цитокин, который подавляется и усиливается талидомидом и его аналогами. Когда моноциты стимулируются липополисахаридамиПродукция IL-12 подавляется, но во время стимуляции Т-лимфоцитов продукция увеличивается. [37]
Считается, что леналидомид примерно в 1000 раз более эффективен in vitro, чем талидомид, по противовоспалительным свойствам, а помалидомид примерно в 10 раз сильнее, чем леналидомид. Однако стоит отметить, что при сравнении леналидомида и помалидомида клиническая значимость более высокой активности in vitro неясна, поскольку максимальная переносимая доза помалидомида составляет 2 мг в день по сравнению с 25 мг для леналидомида, что приводит к снижению концентрации лекарственного средства в плазме крови в 10-100 раз. помалидомид. [39]
Активация Т-клеток [ править ]
Талидомид и его аналоги помогают костимуляции Т-клеток через комплекс B7 - CD28 , фосфорилируя тирозин на рецепторе CD28. [8] Данные in vitro свидетельствуют о том, что эта костимуляция приводит к увеличению высвобождения цитокинов типа Th1 IFN-γ и IL-2, что дополнительно стимулирует пролиферацию клональных Т-клеток, а также пролиферацию и активность естественных клеток-киллеров . Это усиливает естественную и зависимую от антител клеточную цитотоксичность . [40] Леналидомид и помалидомид примерно в 100-1000 раз более эффективны в стимулировании клональной пролиферации Т-клеток, чем талидомид. Кроме того, in vitroданные свидетельствуют о том, что помалидомид превращает клетки Th2 в Th1 за счет усиления фактора транскрипции T-bet . [32]
Антиангиогенез [ править ]
Сообщалось, что ангиогенез или рост новых кровеносных сосудов соответствует прогрессированию ММ, где фактор роста эндотелия сосудов (VEGF) и его рецептор, bFGF [8] и IL-6 [37], по-видимому, необходимы для миграции эндотелиальных клеток во время ангиогенеза. Талидомид и его аналоги , как полагают , для подавления ангиогенеза посредством модуляции указанных выше факторов , где активность анти-ангиогенной активности для леналидомида и pomalidomide в 2-3 раза выше , чем талидомид в различном в естественных условиях анализов, [41] Талидомид также был показано, что он блокирует активность NF-κB посредством блокирования IL-6, и было показано, что NF-κB участвует в ангиогенезе.[37] Ингибирование TNF-α не является механизмом подавления ангиогенеза талидомидом, поскольку многие другие ингибиторы TNF-α не подавляют ангиогенез. [6]
Противоопухолевая активность [ править ]
Считается, что противоопухолевая активность талидомида in vivo обусловлена мощным антиангиогенным действием, а также изменениями экспрессии цитокинов. Исследования in vitro апоптоза в клетках ММ показали, что при обработке талидомидом и его аналогами повышается активность каспазы-8 . Это вызывает перекрестный обмен сигналами апоптоза между каспазой-8 и каспазой-9, что приводит к косвенной активации активности каспазы-9. [32] [38] Дальнейшая противоопухолевая активность опосредуется посредством ингибирования апоптозного белка-2 [41] и эффектов IGF-1 , способствующих выживанию , что увеличивает чувствительность к гибели клеток, опосредованной FAS.и усиление связанного с TNF лиганда, индуцирующего апоптоз . [38] Также было показано, что они вызывают дозозависимую остановку клеточного цикла G0 / G1 в клеточных линиях лейкемии [37], где аналоги показали в 100 раз большую эффективность, чем талидомид. [39]
Среда костного мозга [ править ]
Роль ангиогенеза в поддержании миеломы была впервые обнаружена Vacca в 1994 году. [42] Они обнаружили, что усиление ангиогенеза костного мозга коррелирует с ростом миеломы, а поддерживающие стромальные клетки являются важным источником ангиогенных молекул при миеломе. Считается, что это главный компонент механизма in vivo, с помощью которого талидомид подавляет множественную миелому.
Кроме того, считается, что воспалительные реакции в костном мозге способствуют развитию многих гематологических заболеваний. Секреция IL-6 стромальными клетками костного мозга (BMSC) и секреция молекул адгезии VCAM-1 , ICAM-1 и LFA индуцируются в присутствии TNF-α и адгезии клеток MM к BMSC. IL-6 способствует пролиферации клеточных линий MM и ингибированию Fas-опосредованного апоптоза in vitro. [38] Талидомид и его аналоги непосредственно снижают повышающую регуляцию IL-6 и опосредованно через TNF-α, тем самым уменьшая секрецию молекул адгезии, что приводит к меньшему количеству клеток MM, прикрепляющихся к BMSC. Остеокласты становятся очень активными во время ММ, что приводит крезорбция костей и секреция различных факторов выживания ММ. Они снижают уровни молекул адгезии, которые имеют первостепенное значение для активации остеокластов, уменьшают образование клеток, которые образуют остеокласты, и подавляют катепсин К , важную цистеиновую протеазу, экспрессируемую в остеокластах. [41]
Апремиласт [ править ]
In vitro апремиласт снижает активность PDE4, что приводит к увеличению концентрации циклического аденозинмонофосфата (цАМФ) в иммунных и неиммунных типах клеток, частично ингибируя продукцию многих провоспалительных цитокинов, таких как TNF-α, IFN-γ IL- 2, ИЛ-12 и ИЛ-23 и повышение выработки противовоспалительного цитокина ИЛ-10. [29] [43] Апремиласт по эффективности ингибирования продукции TNF-α аналогичен леналидомиду. [44]
Связь структура-деятельность [ править ]
Поскольку механизм действия талидомида и его аналогов полностью не ясен, а биорецептор для этих веществ не идентифицирован, понимание взаимосвязи между структурой и активностью талидомида и его аналогов в основном получено на основе молекулярного моделирования и продолжающихся исследований. . [17] [45] Информация о SAR талидомида и его аналогов все еще обрабатывается, поэтому любые тенденции, подробно описанные здесь, наблюдаются в ходе отдельных исследований. Исследования в основном сосредоточены на улучшении ингибирования TNF-α и PDE4 талидомида [8] [15], а также противоангиогенезной активности. [46] [47]
Ингибиторы TNF-α (не через PDE4) [ править ]
Исследования показали, что замена во фталоильном кольце увеличивает ингибирующую активность TNF-α (рис. 5). Замещение аминогруппы проверяли в различных местах фталоильного кольца (C4, C5, C6, C7) талидомида и ЕМ-12 (описанного ранее). Добавление аминогруппы в месте C4 как на талидомиде, так и на ЕМ-12 привело к гораздо более сильному ингибированию TNF-α. Это также показало, что аминогруппа должна находиться прямо напротив карбонильной группы в изоиндолиноновой кольцевой системе для наиболее сильной активности. [48] Эти аналоги не ингибируют PDE4 и, следовательно, не действуют путем ингибирования PDE4. Другие добавления более длинных и больших групп в положения C4 и C5 фталоильной кольцевой системы талидомида, некоторые с олефиномфункциональность, были протестированы с различными результатами. Повышенный ингибирующий эффект по сравнению с талидомидом был отмечен для групп, у которых атом кислорода был присоединен непосредственно к олефину C5 или C4. Добавление йода и брома в C4 или C5 приводило к равной или пониженной активности по сравнению с талидомидом. [49] Эти группы не сравнивались с леналидомидом или помалидомидом.
Ингибиторы PDE4 [ править ]
Обычная структура аналогов, которые ингибируют TNF-α посредством ингибирования PDE4, получают на основе гидролиза глутаримидного кольца талидомида. Эти аналоги не содержат кислого хирального водорода, в отличие от талидомида, и поэтому можно ожидать, что они будут хирально стабильными. [16]
На фенильном кольце 3,4-диалкоксифенильный фрагмент (фиг. 6) является известным фармакофором в ингибиторах PDE4, таких как ролипрам . Оптимальная активность достигается с метоксигруппой в 4-м положении (X2) и большей группой, такой как циклопентокси в 3-м положении углерода (X3). Однако аналоги талидомида, ингибирующие PDE4, не соответствуют SAR аналогов ролипрама. Для аналогов талидомида этоксигруппа в X3 и метоксигруппа в X2, где X1 представляет собой просто водород, давали самое высокое ингибирование PDE4 и TNF-α. [15] Заменители большего размера, чем диэтокси в позиции X2 – X3, имели пониженную активность. Эффекты этих замен, по-видимому, опосредованы стерическими эффектами. [16]
Для позиции Y был исследован ряд групп. Замещенные амиды, размер которых превышает размер метиламида (CONHCH 3 ), снижают активность ингибирования PDE4. [16] Используя карбоновую кислоту в качестве отправной точки, амидная группа имеет аналогичную активность ингибирования PDE4, но обе группы, как было показано, были значительно менее эффективны, чем группа сложного метилового эфира, у которой было примерно шестикратное увеличение ингибирующей активности PDE4. Сульфоновая группа имела такое же ингибирование PDE4, что и группа метилового эфира. Наилучшее ингибирование PDE4 наблюдалось при присоединении нитрильной группы, которая имеет в 32 раза большую ингибирующую активность PDE4, чем карбоксильная кислота. [15] Заместители в Y, приводящие к увеличению ингибирующей активности PDE4, таким образом, следовали в следующем порядке:
- COOH ≤ CONH 2 ≤ COOCH 3 ≤ SO 2 CH 3 <CN
Были изучены замены во фталоильном кольце, и было замечено, что нитрогруппы в месте C4 или C5 снижали активность, но замещение C4 или C5 амино резко увеличивало ее. [16] Когда было исследовано замещение в положении 4 (Z) фталоильного кольца, гидроксильные и метоксигруппы, по-видимому, сделали аналог менее мощным ингибитором PDE4. Увеличение активности наблюдали с амино и диметиламино в аналогичной степени, но метильная группа улучшала активность больше, чем вышеупомянутые группы. 4- N- ацетиламиногруппа имела немного более низкую ингибирующую активность в отношении PDE4 по сравнению с метильной группой, но увеличивала ингибирующую активность соединения TNF-α в дополнительной степени. [15] Заместители в Z, ведущие к увеличению ингибирующей активности PDE4, таким образом, следовали в следующем порядке:
- N (CH 3 ) 2 ≤ NH 2 <NHC (O) CH 3 <CH 3
Ингибирование ангиогенеза [ править ]
Для активности ингибирования ангиогенеза, по- видимому, требуется интактное глутаримидное кольцо. Различные группы были протестированы в позиции R. Вещества, содержащие соли азота в качестве R-группы, показали хорошую активность. Улучшенная ингибирующая активность ангиогенеза может быть обусловлена повышенной растворимостью или тем, что положительно заряженный азот добавил взаимодействие с активным сайтом. Тетрафторирование фталоильного кольца, по-видимому, увеличивает ингибирование ангиогенеза. [46]
Синтез [ править ]
Этот раздел может быть слишком техническим для понимания большинством читателей . ( Апрель 2017 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
Ниже описаны схемы синтеза талидомида, леналидомида, помалидомида и апремиласта, как указано в известной первичной литературе . Обратите внимание, что эти схемы синтеза не обязательно отражают стратегии органического синтеза, используемые для синтеза этих отдельных химических соединений.
Талидомид [ править ]
Синтез талидомида обычно проводят, как показано на схеме 1. Этот синтез представляет собой достаточно упрощенный трехступенчатый процесс. Обратной стороной этого процесса, однако, является то, что последняя стадия требует высокотемпературной реакции в расплаве, которая требует многократной перекристаллизации и не соответствует стандартному оборудованию.
Схема 2 представляет собой новый путь синтеза, который был разработан для того, чтобы сделать реакцию более прямой и обеспечить более высокие выходы. В этом способе в качестве исходного материала используется L- глутамин, а не L- глутаминовая кислота, и, позволяя ему реагировать с N- карбетоксифталимидом, получают N- фталоил- L- глутамин (4) с выходом 50–70%. Затем вещество 4 перемешивают в смеси с карбонилдиимидазолом ( CDI ) с достаточным количеством 4-диметиламинопиридина ( DMAP ) в тетрагидрофуране ( THF ), чтобы катализировать реакцию, и нагревают до кипения с обратным холодильником.в течение 15–18 часов. При кипячении из смеси выкристаллизовывается талидомид. Заключительный этап дает выход талидомида 85–93%, в результате чего общий выход составляет 43–63%. [50]
Леналидомид и помалидомид [ править ]
Оба аналогов аминокислот получают из конденсации 3-аминопиперидин-2,6-диона (соединение 3) , которое синтезируется в два этапа реакции из коммерчески доступного Cbz - L -glutamine. Cbz- л -glutamine обрабатывают CDI в ТГФ кипятят с обратным холодильником с получением CBZ-aminoglutarimide. Для удаления защитной группы Cbz был проведен гидрогенолиз под давлением водорода 50-60 фунтов на квадратный дюйм с 10% Pd / C, смешанным с этилацетатом и HCl. Полученный гидрохлорид (соединение 3 на схеме 3) затем подвергали взаимодействию с 3-нитрофталевым ангидридом в кипящей уксусной кислоте с получением 4-нитрозамещенного аналога талидомида и нитрогруппы, затем восстанавливали с помощьюгидрирование с получением помалидомида. [48]
Леналидомид синтезируется аналогичным образом с использованием соединения 3 (3-аминопиперидин-2,6-дион), обработанного нитрозамещенным метил-2- (бромметил) бензоатом, и гидрирования нитрогруппы. [48]
Апремиласт [ править ]
При синтезе апремиласта соединение 3 на схеме 5 получают с выходом 41% из соединения 2, обработанного гексаметилдисилазидом лития , в смеси с диметилсульфоном лития и эфиратом трифторида бора. Разделение соединения 3 было достигнуто обработкой его N- ацетил- L- лейцином с образованием 3S. На последней стадии затем используют конденсацию 3- N- ацетиламинофталевого ангидрида с 3S с получением апремиласта (1S) с выходом 75%. [15]
Фармакокинетика [ править ]
Талидомид [ править ]
| Талидомид | ||
|---|---|---|
| Т макс [препарат] | 4–6 часов по предметам с ММ [51] | |
| Связывание с белками | 55–65% [52] | |
| Метаболиты | Гидролизованные метаболиты [52] | |
| Период полураспада [t 1/2 ] | 5,5–7,6 часов [52] | |
Леналидомид [ править ]
| Леналидомид | ||
|---|---|---|
| Т макс [препарат] | 0,6–1,5 часа у здоровых людей [53] 0,5–4 часа у субъектов с ММ [54] | |
| Связывание с белками | ~ 30% [53] | |
| Метаболиты | Еще не изучено [53] | |
| Период полураспада [t 1/2 ] | 3 часа у здоровых субъектов [53] 3,1–4,2 часа у субъектов с ММ [54] | |
Помалидомид [ править ]
| Помалидомид | ||
|---|---|---|
| Т макс [препарат] | 0,5–8 часов [55] | |
| Связывание с белками | Неизвестный | |
| Метаболиты | Неизвестный | |
| Период полураспада [t 1/2 ] | 6,2–7,9 часов [55] | |
Апремиласт [ править ]
| Апремиласт | ||
|---|---|---|
| Т макс [препарат] | 1,5–2 часа у здоровых людей [56] В среднем 2 часа у пациентов с тяжелым псориазом бляшечного типа [57] | |
| Связывание с белками | ~ 90% [15] | |
| Метаболиты | Глюкуронид O- десметилапремиласта и деметилированный апремиласт вместе с продуктами гидролиза [56] | |
| Период полураспада [t 1/2 ] | 8,2 часа [57] | |
См. Также [ править ]
- Рак
- Множественная миелома
- Дизайн лекарств
- Талидомид
- Леналидомид
- Помалидомид
- Апремиласт
- Органическая химия
- Кризис здоровья
- Иммуномодулирующая терапия
- Иммунодепрессант
- Иммуномодулирующий препарат
Ссылки [ править ]
- ^ a b c Knight, R (август 2005 г.). «IMiDs: новый класс иммуномодуляторов». Семинары по онкологии . 32 (4 Приложение 5): S24 – S30. DOI : 10,1053 / j.seminoncol.2005.06.018 . PMID 16085014 .
- Перейти ↑ Aragon-Ching AB, Li H, Gardner ER, Figg WD (2007). «Аналоги талидомида как противоопухолевые препараты» . Недавние открытия Pat Anticancer Drug Discov . 2 (2): 167–174. DOI : 10.2174 / 157489207780832478 . PMC 2048745 . PMID 17975653 .
- ^ Восстановление фортуны: Как поносит Drug Стало спасительный агент в «войне» против рака - Onco'Zine - Международный онкологической сеть (30 ноября 2013 года ) архивного 3 января 2014 года, в Archive.today
- ^ Mazzoccoli, L; Кадозо, SH; Amarante, GW; де Соуза, МВ; Домингес, Р. Мачадо, Массачусетс; de Almeida, MV; Тейшейра, ХК (июль 2012 г.). «Новые аналоги талидомида из диаминов подавляют выработку провоспалительных цитокинов и экспрессию CD80, одновременно повышая уровень IL-10». Биомедицина и фармакотерапия . 66 (5): 323–9. DOI : 10.1016 / j.biopha.2012.05.001 . PMID 22770990 .
- ^ Prommer, EE (20 октября 2009). «Обзорная статья: Паллиативная онкология: талидомид». Американский журнал хосписов и паллиативной медицины . 27 (3): 198–204. DOI : 10.1177 / 1049909109348981 . PMID 19843880 . S2CID 24167431 .
- ^ a b Д'Амато Р.Дж., Локнан М.С., Флинн Э., Фолкман Дж. (апрель 1994 г.). «Талидомид - ингибитор ангиогенеза» . Proc. Natl. Акад. Sci. США . 91 (9): 4082–5. Полномочный код : 1994PNAS ... 91.4082D . DOI : 10.1073 / pnas.91.9.4082 . PMC 43727 . PMID 7513432 .
- ^ Verheul НМ, Panigrahy D, J Юань, D'Amato RJ (январь 1999). «Комбинированная пероральная антиангиогенная терапия с талидомидом и сулиндаком подавляет рост опухоли у кроликов» . Br. J. Рак . 79 (1): 114–8. DOI : 10.1038 / sj.bjc.6690020 . PMC 2362163 . PMID 10408702 .
- ^ Б с д е е г ч я J K L Бартлетта, Дж Блейка; Дредж, Кейт; Далглиш, Ангус Г. (1 апреля 2004 г.). «Хронология: эволюция талидомида и его производных IMiD как противораковых агентов». Обзоры природы Рак . 4 (4): 314–322. DOI : 10.1038 / nrc1323 . PMID 15057291 . S2CID 7293027 .
- ^ a b D'Amato RJ, Lentzsch S, Anderson KC, Rogers MS (декабрь 2001 г.). «Механизм действия талидомида и 3-аминоталидомида при множественной миеломе». Семин. Онкол . 28 (6): 597–601. DOI : 10.1016 / S0093-7754 (01) 90031-4 . PMID 11740816 .
- ↑ Циммерман, Тодд (1 мая 2009 г.). «Иммуномодуляторы в онкологии». Последние новости о терапии рака . 3 (4): 170–181. DOI : 10.1016 / j.uct.2009.03.003 .
- ^ Zeldis, Джером Б.; Рыцарь, Роберт; Хусейн, Мохамад; Чопра, Раджеш; Мюллер, Джордж (1 марта 2011 г.). «Обзор истории, свойств и использования иммуномодулирующего соединения леналидомид». Летопись Нью-Йоркской академии наук . 1222 (1): 76–82. Bibcode : 2011NYASA1222 ... 76Z . DOI : 10.1111 / j.1749-6632.2011.05974.x . PMID 21434945 . S2CID 5336195 .
- ^ http://vectorblog.org/2013/04/from-thalidomide-to-pomalyst-better-living-through-chemistry/
- ^ а б Д'Амато, RJ; Lentzsch, S; Андерсон, KC; Роджерс, MS (декабрь 2001 г.). «Механизм действия талидомида и 3-аминоталидомида при множественной миеломе». Семинары по онкологии . 28 (6): 597–601. DOI : 10.1016 / S0093-7754 (01) 90031-4 . PMID 11740816 .
- ^ Lentzsch S, Rogers MS, LeBlanc R и др. (Апрель 2002 г.). «S-3-амино-фталимидо-глутаримид подавляет ангиогенез и рост B-клеточных неоплазий у мышей». Cancer Res . 62 (8): 2300–5. PMID 11956087 .
- ^ a b c d e f g h i j k Man, Hon-Wah; Шафер, Питер; Вонг, Лу Минь; Паттерсон, Ребекка Т .; Corral, Laura G .; Раймон, Хизер; Близ, Кейт; Лейстен, Джим; Ширли, Майкл А .; Тан, Ян; Babusis, Darius M .; Чен, Роджер; Стирлинг, Дэйв; Мюллер, Джордж У. (26 марта 2009 г.). "Открытие ( S ) - N - {2- [1- (3-этокси-4-метоксифенил) -2-метансульфонилэтил] -1,3-диоксо-2,3-дигидро- 1H- изоиндол-4-ила } ацетамид (апремиласт), сильнодействующий и активный при пероральном применении ингибитор фосфодиэстеразы 4 и фактора некроза опухоли-α ». Журнал медицинской химии . 52 (6): 1522–4. Дои: 10.1021 / jm900210d . PMID 19256507 .
- ^ a b c d e f g h i j Muller, George W .; Corral, Laura G .; Шир, Мэри Дж .; Ван, Хуа; Морейра, Андре; Каплан, Гилла; Стирлинг, Дэвид И. (1 января 1996 г.). «Структурные модификации талидомида производят аналоги с повышенной активностью ингибирования фактора некроза опухоли». Журнал медицинской химии . 39 (17): 3238–3240. DOI : 10.1021 / jm9603328 . PMID 8765505 .
- ^ a b c d e Человек, Хон-Ва; Corral, Laura G; Стирлинг, Дэвид I; Мюллер, Джордж В. (1 октября 2003 г.). «α-Фторзамещенные аналоги талидомида». Письма по биоорганической и медицинской химии . 13 (20): 3415–3417. DOI : 10.1016 / S0960-894X (03) 00778-9 . PMID 14505639 .
- ^ Пан, B; Lentzsch, S (октябрь 2012 г.). «Применение и биология иммуномодулирующих препаратов (IMiD) при раке». Фармакология и терапия . 136 (1): 56–68. DOI : 10.1016 / j.pharmthera.2012.07.004 . PMID 22796518 .
- ^ Седларикова, Л; Кубичкова, Л; Севчикова, С; Хайек, Р. (октябрь 2012 г.). «Механизм действия иммуномодулирующих препаратов при миеломной болезни». Исследование лейкемии . 36 (10): 1218–1224. DOI : 10.1016 / j.leukres.2012.05.010 . PMID 22727252 .
- ^ а б в г Валле, S; Witzens-Harig, M; Jaeger, D; Подар, К (март 2012). «Последняя информация об иммуномодулирующих препаратах (IMiD) при гематологических и солидных злокачественных новообразованиях». Мнение эксперта по фармакотерапии . 13 (4): 473–494. DOI : 10.1517 / 14656566.2012.656091 . PMID 22324734 . S2CID 7981368 .
- ^ «Дозирование таломида (талидомида), показания, взаимодействия, побочные эффекты и многое другое» . Ссылка на MedScape . Проверено 18 сентября 2012 года .
- ^ "Талидомид Celgene (ранее Thalidomide Pharmion)" . Европейское агентство по лекарственным средствам . Проверено 18 сентября 2012 года .
- ^ «Celgene Biopharmaceutical - Связи с инвесторами - Пресс-релизы» . Архивировано из оригинального 19 января 2013 года . Проверено 18 сентября 2012 года .
- ^ «Ревлимид (леналидомид) дозировка, показания, взаимодействия, побочные эффекты и многое другое» . Ссылки Medscape . Проверено 18 сентября 2012 года .
- ^ "Поиск: леналидомид - Список результатов" . Клинические испытания . Проверено 18 сентября 2012 года .
- ^ "Регистр клинических испытаний" . Регистр клинических испытаний ЕС . Проверено 18 сентября 2012 года .
- ^ "Celgene представляет помалидомид для утверждения FDA" . Маяк миеломы.
- ^ «Европейское агентство по лекарственным средствам - Результаты поиска по вашему запросу» . Европейское агентство по лекарственным средствам . Проверено 18 сентября 2012 года .
- ^ a b Шафер, Питер (1 июня 2012 г.). «Механизм действия и применение апремиласта при псориазе и псориатическом артрите». Биохимическая фармакология . 83 (12): 1583–1590. DOI : 10.1016 / j.bcp.2012.01.001 . PMID 22257911 .
- ^ «FDA одобряет Otezla для лечения псориатического артрита» . fda.gov . Проверено 13 июня 2014 .
- ^ а б Ито, Такуми; Ханда, Хироши (1 марта 2012 г.). «Расшифровка тайны тератогенности талидомида» . Врожденные аномалии . 52 (1): 1–7. DOI : 10.1111 / j.1741-4520.2011.00351.x . PMID 22348778 .
- ^ a b c d e Мартиниани, Роберта; Ди Лорето, Валентина; Ди Сано, Кьяра; Ломбардо, Алессандра; Либерати, Анна Марина (1 января 2012 г.). «Биологическая активность леналидомида и его терапевтические эффекты при множественной миеломе» . Достижения в гематологии . 2012 : 842945. дои : 10,1155 / 2012/842945 . PMC 3417169 . PMID 22919394 .
- ^ Quach, H; Ричи, Д; Стюарт, AK; Neeson, P; Харрисон, S; Смит, MJ; Принц, HM (январь 2010 г.). «Механизм действия иммуномодулирующих препаратов (IMiDS) при множественной миеломе» . Лейкоз . 24 (1): 22–32. DOI : 10.1038 / leu.2009.236 . PMC 3922408 . PMID 19907437 .
- ^ Андхаварапу, S; Рой, V (февраль 2013 г.). «Иммуномодулирующие препараты при множественной миеломе» . Гематологическая экспертиза . 6 (1): 69–82. DOI : 10.1586 / ehm.12.62 . PMID 23373782 . S2CID 12782141 .
- ^ Седларикова, Л; Кубичкова, Л; Севчикова, С; Хайек, Р. (октябрь 2012 г.). «Механизм действия иммуномодулирующих препаратов при миеломной болезни». Исследование лейкемии . 36 (10): 1218–1224. DOI : 10.1016 / j.leukres.2012.05.010 . PMID 22727252 .
- ^ Чанг, XB; Стюарт, АК (2011). «Какова функциональная роль церблона, связывающего талидомид?» . Международный журнал биохимии и молекулярной биологии . 2 (3): 287–94. PMC 3193296 . PMID 22003441 .
- ^ a b c d e f Хуанг, Йен-Та; Hsu, Chih W .; Чиу, Тед Х. (1 сентября 2008 г.). «Талидомид и его аналоги как противораковые средства» . Медицинский журнал Цзы Чи . 20 (3): 188–195. DOI : 10.1016 / S1016-3190 (08) 60034-8 .
- ^ a b c d e Мельхерт, Магда; Лист, Алан (1 июля 2007 г.). «Сага о талидомиде». Международный журнал биохимии и клеточной биологии . 39 (7–8): 1489–1499. DOI : 10.1016 / j.biocel.2007.01.022 . PMID 17369076 .
- ^ a b Quach, H; Ричи, Д; Стюарт, AK; Neeson, P; Харрисон, S; Смит, MJ; Принц, HM (12 ноября 2009 г.). «Механизм действия иммуномодулирующих препаратов (IMiDS) при множественной миеломе» . Лейкоз . 24 (1): 22–32. DOI : 10.1038 / leu.2009.236 . PMC 3922408 . PMID 19907437 .
- ^ Томас, Шиба К .; Richards, Tiffany A .; Вебер, Донна М. (1 декабря 2007 г.). «Леналидомид при миеломной болезни». Передовая практика и исследования в клинической гематологии . 20 (4): 717–735. DOI : 10.1016 / j.beha.2007.09.002 . PMID 18070715 .
- ^ a b c Котла, Венумадхав; Гоэль, Свати; Нишал, Сангита; Хейк, Кристоф; Вивек, Кумар; Дас, Бхаскар; Верма, Амит (1 января 2009 г.). «Механизм действия леналидомида при злокачественных гематологических заболеваниях» . Журнал гематологии и онкологии . 2 (1): 36. DOI : 10,1186 / 1756-8722-2-36 . PMC 2736171 . PMID 19674465 .
- ^ Вакка А., Рибатти Д., Ронкали Л. и др. (Июль 1994 г.). «Ангиогенез костного мозга и прогрессирование множественной миеломы» . Br. J. Haematol . 87 (3): 503–8. DOI : 10.1111 / j.1365-2141.1994.tb08304.x . PMC 3301416 . PMID 7527645 .
- ^ Шафер, PH; Партон, А; Ганди, AK; Капоне, L; Адамс, М; Wu, L; Bartlett, JB; Лавленд, Массачусетс; Гилхар, А; Cheung, YF; Бэйли, GS; Houslay, MD; Мужчина, HW; Мюллер, GW; Стирлинг, Д.И. (1 февраля 2010 г.). «Апремиласт, ингибитор цАМФ-фосфодиэстеразы-4, демонстрирует противовоспалительную активность in vitro и на модели псориаза» . Британский журнал фармакологии . 159 (4): 842–855. DOI : 10.1111 / j.1476-5381.2009.00559.x . PMC 2829210 . PMID 20050849 .
- ^ Микелли, Miranda L. (2011). Цирроз печени: причины, диагностика и лечение . Нью-Йорк: Биомедицинские книги Нова. ISBN 978-1-61209-248-5.
- ^ Авила, Каролина Мартинс; Ромейро, Нелильма Коррейя; Sperandio da Silva, Gilberto M .; Сант'Анна, Карлос MR; Barreiro, Eliezer J .; Фрага, Карлос А.М. (1 октября 2006 г.). «Разработка новых моделей CoMFA и CoMSIA 3D-QSAR для противовоспалительных модуляторов TNFα, содержащих фталимид». Биоорганическая и медицинская химия . 14 (20): 6874–6885. DOI : 10.1016 / j.bmc.2006.06.042 . PMID 16843662 .
- ^ a b Леппер, Эрин Р .; Нг, Сильвия SW; Гютшов, Майкл; Вайс, Майкл; Хаушильдт, Сунна; Хеккер, Томас К .; Луццио, Фредерик А .; Эгер, Курт; Фигг, Уильям Д. (1 апреля 2004 г.). "Сравнительный анализ молекулярного поля и сравнительный анализ показателей молекулярного сходства аналогов талидомида как ингибиторов ангиогенеза". Журнал медицинской химии . 47 (9): 2219–2227. DOI : 10.1021 / jm0304820 . PMID 15084120 .
- ^ Ногучи, Томоми; Фудзимото, Харука; Сано, Хироко; Миядзима, Ацуши; Миячи, Хироюки; Хашимото, Юичи (1 декабря 2005 г.). «Ингибиторы ангиогенеза, полученные из талидомида». Письма по биоорганической и медицинской химии . 15 (24): 5509–5513. DOI : 10.1016 / j.bmcl.2005.08.086 . PMID 16183272 .
- ^ a b c Мюллер, GW; Chen, R; Huang, SY; Corral, LG; Вонг, Л. М.; Паттерсон, RT; Чен, Y; Каплан, G; Стирлинг, Д.И. (7 июня 1999 г.). «Аминозамещенные аналоги талидомида: сильные ингибиторы производства TNF-альфа». Письма по биоорганической и медицинской химии . 9 (11): 1625–30. DOI : 10.1016 / s0960-894x (99) 00250-4 . PMID 10386948 .
- ^ Стюарт, Скотт Дж .; Спаньоло, Даниэль; Поломска, Марта Э .; Грех, Мелвин; Карими, Махдад; Абрахам, Лоуренс Дж. (1 ноября 2007 г.). «Свойства ингибирования синтеза и экспрессии TNF новых аналогов талидомида, полученных с помощью перекрестного связывания Хека». Письма по биоорганической и медицинской химии . 17 (21): 5819–5824. DOI : 10.1016 / j.bmcl.2007.08.042 . PMID 17851074 .
- ^ Мюллер, Джордж В .; Konnecke, William E .; Смит, Элисон М .; Хетани, Викрам Д. (1 марта 1999 г.). «Краткий двухэтапный синтез талидомида». Исследования и разработки в области органических процессов . 3 (2): 139–140. DOI : 10.1021 / op980201b .
- Перейти ↑ Chung, F. (1 сентября 2004 г.). «Фармакокинетика талидомида и образование метаболитов у мышей, кроликов и пациентов с множественной миеломой» . Клинические исследования рака . 10 (17): 5949–5956. DOI : 10.1158 / 1078-0432.CCR-04-0421 . PMID 15355928 .
- ^ a b c "Краткое описание характеристик продукта: Талидомид Celgene" (PDF) . Европейское агентство по лекарственным средствам . Проверено 23 сентября 2012 года .
- ^ a b c d Armoiry, X .; Aulagner, G .; Факон, Т. (1 июня 2008 г.). «Леналидомид в лечении множественной миеломы: обзор» . Журнал клинической фармации и терапии . 33 (3): 219–226. DOI : 10.1111 / j.1365-2710.2008.00920.x . PMID 18452408 .
- ^ a b Ричардсон, PG (12 июля 2002 г.). «Иммуномодулирующий препарат CC-5013 преодолевает лекарственную устойчивость и хорошо переносится пациентами с рецидивирующей множественной миеломой» . Кровь . 100 (9): 3063–3067. DOI : 10.1182 / кровь-2002-03-0996 . PMID 12384400 .
- ^ a b Schey, SA (15 августа 2004 г.). «Фаза I исследования иммуномодулирующего аналога талидомида, CC-4047, при рецидивирующей или рефрактерной множественной миеломе». Журнал клинической онкологии . 22 (16): 3269–3276. DOI : 10.1200 / JCO.2004.10.052 . PMID 15249589 .
- ^ a b Hoffmann, M; Кумар, G; Schafer, P; Cedzik, D; Капоне, L; Фонг, KL; Гу, Z; Heller, D; Feng, H; Surapaneni, S; Ласкин, О; Ву, А (декабрь 2011 г.). «Диспозиция, метаболизм и массовый баланс [ 14 C] апремиласта после перорального приема» . Xenobiotica . 41 (12): 1063–75. DOI : 10.3109 / 00498254.2011.604745 . PMC 3231940 . PMID 21859393 .
- ^ a b Готтлиб, AB; Стробер, Б; Крюгер, Дж. Г.; Rohane, P; Zeldis, JB; Ху, СС; Кипнис, К. (май 2008 г.). «Открытое пилотное исследование с участием одной руки у пациентов с тяжелым псориазом бляшечного типа, получавших пероральный противовоспалительный агент апремиласт». Текущие медицинские исследования и мнения . 24 (5): 1529–38. DOI : 10.1185 / 030079908X301866 . PMID 18419879 . S2CID 72491350 .