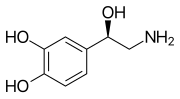
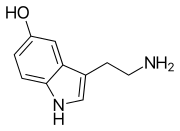
Моноаминовые нейротрансмиттеры - это нейротрансмиттеры и нейромодуляторы, которые содержат одну аминогруппу, связанную с ароматическим кольцом двухуглеродной цепью (например, -CH 2 -CH 2 -). Примеры - дофамин , норэпинефрин и серотонин .
Все моноамины получают из ароматических аминокислот, таких как фенилаланин , тирозин и триптофан, под действием ферментов декарбоксилазы ароматических аминокислот . Они дезактивируются в организме ферментами, известными как моноаминоксидазы, которые отрезают аминогруппу.
Моноаминергические системы, то есть сети нейронов, которые используют моноаминовые нейротрансмиттеры, участвуют в регуляции таких процессов, как эмоции, возбуждение и определенные типы памяти. Также было обнаружено, что моноаминовые нейротрансмиттеры играют важную роль в секреции и производстве нейротрофина-3 астроцитами, химического вещества, которое поддерживает целостность нейронов и обеспечивает нейроны трофической поддержкой. [1]
Лекарства, используемые для увеличения или уменьшения действия моноаминовых нейромедиаторов, используются для лечения пациентов с психическими и неврологическими расстройствами, включая депрессию , тревожность , шизофрению и болезнь Паркинсона . [2]
Примеры [ править ]
- Классические моноамины
- Имидазоламины :
- Гистамин [6]
- Катехоламины :
- Адреналин (Ad; Адреналин, Эпи)
- Дофамин (DA)
- Норадреналин (NAd; норадреналин, NE)
- Индоламины :
- Серотонин (5-HT)
- Мелатонин (MT)
- Следы аминов
- Фенэтиламины (относящиеся к катехоламинам ):
- Фенэтиламин [7] [8] [9] (PEA)
- N- Метилфенэтиламин [10] [7] [9] (эндогенныйизомер амфетамина )
- Фенилэтаноламин [11] [9]
- м- тирамин [7] [9]
- п- тирамин [7] [9]
- 3-метокситирамин [10] [9]
- N- Метилтирамин [10] [7] [9]
- м- октопамин [7] [9]
- п- октопамин [7] [9]
- Синефрин [10] [9]
- Триптамин [10] [8] [9]
Существуют специфические белки- переносчики, называемые переносчиками моноаминов, которые переносят моноамины в клетку или из клетки. Это переносчик дофамина (DAT), переносчик серотонина (SERT) и переносчик норадреналина (NET) во внешней клеточной мембране и везикулярный переносчик моноаминов ( VMAT1 и VMAT2 ) в мембране внутриклеточных везикул . [ необходима цитата ]
После высвобождения в синаптическую щель действие моноаминового нейромедиатора прекращается за счет обратного захвата в пресинаптическом окончании. Там они могут быть переупакованы в синаптические везикулы или разложены ферментом моноаминоксидазой (МАО), который является мишенью ингибиторов моноаминоксидазы , класса антидепрессантов . [ необходима цитата ]
Эволюция [ править ]
Системы моноаминовых нейротрансмиттеров встречаются практически у всех позвоночных, и эволюционируемость этих систем способствовала адаптации видов позвоночных к разным условиям окружающей среды. [12] [13]
См. Также [ править ]
- Ингибитор обратного захвата моноаминов
- Рецептор моноамина
- Моноаминоксидаза
- Транспортер моноаминов
- Гипотеза моноаминов
- Биогенный амин
- Следы амина
- Моноаминовые ядра
- Биология депрессии
Ссылки [ править ]
- ^ Мел, Тина; Чарман-Кржан, Мария; Юрич, Дамиана Мойца (2010). «Регуляторная роль моноаминовых нейромедиаторов в астроцитарном синтезе NT-3». Международный журнал нейробиологии развития . 28 (1): 13–9. DOI : 10.1016 / j.ijdevneu.2009.10.003 . PMID 19854260 . S2CID 25734591 .
- ^ Куриан, Манджу А; Гиссен, Пол; Смит, Мартин; Heales, Саймон-младший; Клейтон, Питер Т (2011). «Расстройства моноаминовых нейротрансмиттеров: расширяющийся спектр неврологических синдромов». Ланцетная неврология . 10 (8): 721–33. DOI : 10.1016 / S1474-4422 (11) 70141-7 . PMID 21777827 . S2CID 32271477 .
- ^ Broadley KJ (март 2010). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. DOI : 10.1016 / j.pharmthera.2009.11.005 . PMID 19948186 .
- ^ Lindemann L, Hoener MC (май 2005). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Направления фармакологических наук . 26 (5): 274–281. DOI : 10.1016 / j.tips.2005.03.007 . PMID 15860375 .
- Перейти ↑ Wang X, Li J, Dong G, Yue J (февраль 2014 г.). «Эндогенные субстраты мозга CYP2D». Европейский журнал фармакологии . 724 : 211–218. DOI : 10.1016 / j.ejphar.2013.12.025 . PMID 24374199 .
- ^ Ромеро-Кальдерон Р., Уленброк Г., Бориц Дж., Саймон А.Ф., Григорук А., Йи С.К., Шайер А., Акерсон Л.С., Мейдмент Н.Т., Майнерцхаген И.А., Ховеманн Б.Т., Кранц Д.Е. (ноябрь 2008 г.). «Глиальный вариант везикулярного переносчика моноаминов необходим для хранения гистамина в зрительной системе дрозофилы» . PLOS Genet . 4 (11): e1000245. DOI : 10.1371 / journal.pgen.1000245 . PMC 2570955 . PMID 18989452 .
В отличие от других моноаминовых нейротрансмиттеров, механизм, с помощью которого регулируется содержание гистамина в головном мозге, остается неясным. У млекопитающих везикулярные переносчики моноаминов (VMAT) экспрессируются исключительно в нейронах и опосредуют хранение гистамина и других моноаминов.
- ^ Б с д е е г Броадли KJ (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Pharmacol. Ther . 125 (3): 363–375. DOI : 10.1016 / j.pharmthera.2009.11.005 . PMID 19948186 .
Следовые амины метаболизируются в организме млекопитающих с помощью моноаминоксидазы (MAO; EC 1.4.3.4) (Berry, 2004) (рис. 2) ... Он дезаминирует первичные и вторичные амины, которые свободны в цитоплазме нейронов, но не связаны с нейронами. везикулы хранения симпатического нейрона ... Точно так же β-PEA не будет дезаминироваться в кишечнике, поскольку он является селективным субстратом для MAO-B, который не обнаруживается в кишечнике ...
Уровни эндогенных следовых аминов в мозге в несколько сотен раз ниже, чем у классических нейромедиаторов норадреналина, дофамина и серотонина, но их скорость синтеза эквивалентна таковой для норадреналина и дофамина, и они имеют очень высокую скорость обмена (Berry, 2004). Уровни следов аминов в эндогенной внеклеточной ткани, измеренные в головном мозге, находятся в низком наномолярном диапазоне. Эти низкие концентрации возникают из-за их очень короткого периода полураспада ... - ^ a b Миллер GM (январь 2011 г.). «Возникающая роль следового аминосвязанного рецептора 1 в функциональной регуляции переносчиков моноаминов и дофаминергической активности» . J. Neurochem . 116 (2): 164–176. DOI : 10.1111 / j.1471-4159.2010.07109.x . PMC 3005101 . PMID 21073468 .
- ^ Б с д е е г ч я J K Хан М.З., Наваз Вт (октябрь 2016). «Новые роли человеческих следовых аминов и человеческих следовых амино-ассоциированных рецепторов (hTAAR) в центральной нервной системе». Биомед. Фармакотер . 83 : 439–449. DOI : 10.1016 / j.biopha.2016.07.002 . PMID 27424325 .
- ^ a b c d e Lindemann L, Hoener MC (май 2005 г.). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Trends Pharmacol. Sci . 26 (5): 274–281. DOI : 10.1016 / j.tips.2005.03.007 . PMID 15860375 .
Помимо основного метаболического пути, ТА могут также превращаться неспецифической N-метилтрансферазой (NMT) [22] и фенилэтаноламин-N-метилтрансферазой (PNMT) [23] в соответствующие вторичные амины (например, синефрин [14], N-метилфенилэтиламин. и N-метилтирамин [15]), которые проявляют аналогичную активность в отношении TAAR1 (TA1), что и их предшественники первичного амина ... И дофамин, и 3-метокситирамин, которые не подвергаются дальнейшему N-метилированию, являются частичными агонистами TAAR1 (TA1) . ...
Нарушение регуляции уровней TA было связано с несколькими заболеваниями, что подчеркивает соответствующие члены семейства TAAR как потенциальные цели для разработки лекарств. В этой статье мы сосредотачиваемся на значимости ТА и их рецепторов для расстройств нервной системы, а именно шизофрении и депрессии; однако ТА также связаны с другими заболеваниями, такими как мигрень, синдром дефицита внимания и гиперактивности, злоупотребление психоактивными веществами и расстройства пищевого поведения [7,8,36]. Клинические исследования сообщают о повышенных уровнях β-ПЭА в плазме у пациентов, страдающих острой шизофренией [37], и повышенной экскреции β-ПЭА с мочой у параноидальных шизофреников [38], что подтверждает роль ТА при шизофрении. В результате этих исследований β-PEA был назван «эндогенным амфетамином» организма [39]. - ^ Wainscott DB, Little SP, Инь T, Tu Y, Rocco В.П., Он JX, Нельсон DL (январь 2007). «Фармакологическая характеристика клонированного человеческого следового аминосвязанного рецептора1 (TAAR1) и доказательства видовых различий с TAAR1 крысы». Журнал фармакологии и экспериментальной терапии . 320 (1): 475–85. DOI : 10,1124 / jpet.106.112532 . PMID 17038507 . S2CID 10829497 .
- ^ Callier S, M Snapyan, Le Кром S, Prou D, Винсент JD, Вернье P (2003). «Эволюция и клеточная биология дофаминовых рецепторов у позвоночных». Биология клетки . 95 (7): 489–502. DOI : 10.1016 / s0248-4900 (03) 00089-3 . PMID 14597267 . S2CID 18277786 .
Эта «эволюционируемость» дофаминовых систем сыграла важную роль в адаптации видов позвоночных почти ко всем возможным средам.
- ^ Винсент JD, Cardinaud B, Вернье P (1998). «[Эволюция моноаминовых рецепторов и происхождение мотивационных и эмоциональных систем у позвоночных]». Bulletin de l'Académie Nationale de Médecine (на французском языке). 182 (7): 1505–14, обсуждение 1515–6. PMID 9916344 .
Эти данные предполагают, что дупликация гена рецептора D1 / бета необходима для выработки новых психомоторных адаптивных ответов на катехоламины и что норадренергическая система определенно возникла у истоков эволюции позвоночных.
Внешние ссылки [ править ]
- Биогенные + моноамины в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)