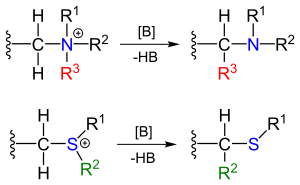
Перегруппировки Стивенса в органической химии является органическая реакция превращения четвертичные соли аммония и сульфония солей в соответствующие амины или сульфиды , в присутствии сильного основания в 1,2-перегруппировке . [1]
Реагенты могут быть получены алкилированием соответствующих аминов и сульфидов. Заместитель R рядом с амином метиленового мостика представляет собой электроноакцепторную группу .
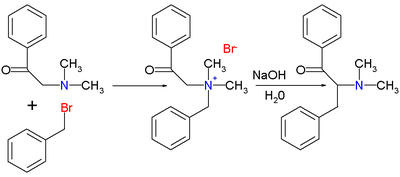
Оригинальная публикация Томаса С. Стивенса [2] 1928 года касалась реакции 1-фенил-2- (N, N-диметиламино) этанона с бензилбромидом до аммониевой соли с последующей реакцией перегруппировки с гидроксидом натрия в воде до перегруппированной амин.
В публикации 1932 г. [3] описана соответствующая реакция серы.
Механизм реакции [ править ]
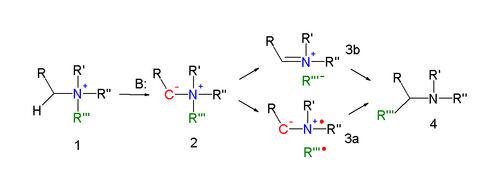
Механизм реакции перегруппировки Стивенса - один из самых спорных механизмов реакции в органической химии. [4] Ключевым в механизме реакции [5] [6] перегруппировки Стивенса (объясненной для реакции азота) является образование илида после депротонирования соли аммония сильным основанием. Депротонированию способствуют электроноакцепторные свойства заместителя R. Для реальной реакции перегруппировки существует несколько режимов реакции.
Согласованная реакция требует antarafacial режима реакции , но так как мигрирующие группы отображают сохранение конфигурации этого механизм является маловероятным.
В альтернативном механизме реакции связь N – C уходящей группы гомолитически расщепляется с образованием дирадикальной пары ( 3a ). Чтобы объяснить наблюдаемое сохранение конфигурации, используется клетка для растворителя . Другая возможность - образование пары катион-анион ( 3b ), также в клетке растворителя.
Сфера [ править ]
Конкурирующие реакции - это перегруппировка Соммлета-Хаузера и исключение Хофмана .
В одном приложении двойная перегруппировка Стивенса расширяет циклофановое кольцо. [7] илид получает на месте посредством реакции диазо соединения этила diazomalonate с сульфидом , катализируемой dirhodium тетраацетатом в кипячении с обратным холодильником ксилола .
Ферментативная реакция [ править ]
В последнее время , γ-бутиробетаин гидроксилазы , [8] [9] фермента , который участвует в человеческом биосинтеза карнитина пути, было обнаружено , что катализируют в связи СС реакции образования в моде аналогичен типу перегруппировки Стивенса. [8] [10] Субстратом реакции является мельдоний . [11]
См. Также [ править ]
- Перегруппировка Соммеле – Хаузера
- γ-Бутиробетаин гидроксилаза
Ссылки [ править ]
- ^ Pine SH (2011). Перегруппировки четвертичных аммониевых солей, стимулированные основанием. Органические реакции . Органические реакции . С. 403–464. DOI : 10.1002 / 0471264180.or018.04 . ISBN 978-0471264187.
- Перейти ↑ Stevens TS, Creighton EM, Gordon AB, MacNicol M (1928). «CCСXXIII. - Разложение солей четвертичного аммония. Часть I » . J. Chem. Soc. : 3193–3197. DOI : 10.1039 / JR9280003193 .
- ^ Стивенс, TS; и другие. (1932). «8. Разложение солей четвертичного аммония. Часть V. Молекулярная перегруппировка в родственных соединениях серы». J. Chem. Soc. : 69. DOI : 10.1039 / JR9320000069 .
- ^ Bhakat, S (2011). «Спорный механизм реакции перегруппировки Стивенса: обзор». J. Chem. Pharm. Res . 3 (1): 115–121.
- Перейти ↑ MB Smith, J March. Мартовская продвинутая органическая химия (Wiley, 2001) ( ISBN 0-471-58589-0 )
- ^ Стратегическое применение названных реакций в органическом синтезе Ласло Курти, Barbara Czako Academic Press (4 марта 2005 г. ) ISBN 0-12-429785-4
- ^ Расширение кольца макроцикла двойной перестановкой Стивенса Кейша К. Эллис-Холдер, Брайан П. Пепперс, Андрей Ю. Ковалевский и Стивен Т. Дайвер Орг. Lett .; 2006 ; 8 (12), стр. 2511–2514; (Письмо) ‹См. Tfd› doi : 10.1021 / ol060657a
- ^ a b Леунг IKH, Krojer TJ, Kochan GT, Henry L, von Delft F, Claridge TDW, Oppermann U, McDonough MA, Schofield CJ (декабрь 2010 г.). «Структурные и механистические исследования γ-бутиробетаингидроксилазы» . Chem. Биол . 17 (12): 1316–24. DOI : 10.1016 / j.chembiol.2010.09.016 . PMID 21168767 .
- ^ Смола К, Rumnieks Дж, Зелтиньши А, казахи А, Kotelovica S, Leonciks А, Sharipo Дж, Viksna А, Куку Дж, Лиепиньши Е, Dambrova М (август 2010 г.). «Кристаллическая структура гамма-бутиробетаингидроксилазы человека». Биохим. Биофиз. Res. Commun . 398 (4): 634–9. DOI : 10.1016 / j.bbrc.2010.06.121 . PMID 20599753 .
- ^ Генри L, Leung IKH, Claridge TDW, Шофилд CJ (август 2012). «γ-Бутиробетаингидроксилаза катализирует перегруппировку типа Стивенса». Биоорг. Med. Chem. Lett . 22 (15): 4975–4978. DOI : 10.1016 / j.bmcl.2012.06.024 . PMID 22765904 .
- ^ Симхович BZ, Шутенко З.В., Meirena Д.В., Khagi KB, Mezapuķe RJ, молодчина TN, Калвиньш И.Я., Лукевиц E (январь 1988). «3- (2,2,2-Триметилгидразиниум) пропионат (THP) - новый ингибитор гамма-бутиробетаингидроксилазы с кардиозащитными свойствами». Биохим. Pharmacol . 37 (2): 195–202. DOI : 10.1016 / 0006-2952 (88) 90717-4 . PMID 3342076 .