 Sn 2+ ; F - | |
| Имена | |
|---|---|
| Название ИЮПАК Фторид олова (II) | |
| Другие имена Олово фторид | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ECHA InfoCard | 100.029.090 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 3288 |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| SnF 2 | |
| Молярная масса | 156,69 г / моль |
| Внешность | бесцветное твердое вещество |
| Плотность | 4,57 г / см 3 |
| Температура плавления | 213 ° С (415 ° F, 486 К) |
| Точка кипения | 850 ° С (1560 ° F, 1120 К) |
| 31 г / 100 мл (0 ° C); 35 г / 100 мл (20 ° С); 78,5 г 100 мл (106 ° C) | |
| Растворимость | растворим в КОН , KF ; незначительно в этаноле , эфире , хлороформе |
| Структура | |
| Моноклиника , мс 48 | |
| C2 / c, №15 | |
| Фармакология | |
| A01AA04 ( ВОЗ ) | |
| Опасности | |
| Паспорт безопасности | ICSC 0860 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другие анионы | (II) , хлорид олова , олова (II) , бромид , Олово йодида (II) , |
Другие катионы | Германий тетрафторид , Олово тетрафторид , свинца (II) , фторид |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фторид олова (II) , обычно называемый в промышленных масштабах фторидом олова [1] [2] (от латинского stannum , «олово»), представляет собой химическое соединение с формулой SnF 2 . Это бесцветное твердое вещество, используемое в качестве ингредиента зубных паст .
Профилактика кариеса [ править ]
Фторид олова был введен как альтернатива фториду натрия для предотвращения кариеса. Для этой цели он был введен Джозефом Мюлером и Уильямом Небергаллом. В знак признания их новаторства эти два человека были занесены в Зал славы изобретателей. [1]
Фторид олова превращает кальциевый минерал апатит во фторапатит , что делает зубную эмаль более устойчивой к кислотным атакам, генерируемым бактериями . [3] Большинство зубных паст содержат минералы кальция [ необходима цитата ] ; со временем они вступают в реакцию с фторидом натрия с образованием фторида кальция , который почти полностью нерастворим и, следовательно, неэффективен для защиты зубов. Фторид олова является более стабильным ингредиентом и, таким образом, остается эффективным в укреплении зубной эмали при более длительном хранении. [4] Фторид олова оказался столь же эффективным, как и фторид натрия.в снижении заболеваемости кариесом [5] и борьбе с гингивитом . [6]
Фторид олова использовался под торговым названием Fluoristan в первоначальном составе зубной пасты марки Crest , хотя позже он был заменен монофторфосфатом натрия под торговым названием Fluoristat. Фторид олова является активным ингредиентом зубной пасты Crest Pro Health. Crest Pro Health выдает предупреждение на тюбике о том, что фторид олова может вызвать окрашивание, чего можно избежать с помощью правильной чистки, и что его конкретный состав устойчив к окрашиванию. Однако любое окрашивание фторидом олова из-за неправильной чистки зубов не является постоянным. Фторид олова также используется в составе Oral-B Pro-Expert . [7] Фторид олова также легко продается в виде ополаскивателей.
Производство [ править ]
SnF 2 может быть получен путем выпаривания раствора SnO в 40% HF . [8]
- SnO + 2 HF → SnF 2 + H 2 O
Водные растворы [ править ]
SnF 2 легко растворяется в воде и подвергается гидролизу. При низкой концентрации он образует такие виды, как SnOH + , Sn (OH) 2 и Sn (OH) 3 - . При более высоких концентрациях образуются преимущественно полиядерные частицы, включая Sn 2 (OH) 2 2+ и Sn 3 (OH) 4 2+ . [9] Водные растворы легко окисляются с образованием нерастворимых осадков Sn IV , которые неэффективны в качестве стоматологического профилактического средства. [10] Исследования окисления с помощью мессбауэровской спектроскопии на замороженных образцах позволяют предположить, что O 2является окислителем. [11]
Кислотность Льюиса [ править ]
SnF 2 действует как кислота Льюиса . Например, он образует комплекс 1: 1 (CH 3 ) 3 NSnF 2 и комплекс 2: 1 [(CH 3 ) 3 N] 2 SnF 2 с триметиламином , [12] и комплекс 1: 1 с диметилсульфоксидом , (CH 3 ) 2 SO · SnF 2 . [13]
В растворах, содержащих фторид-ион, F - , он образует фторидные комплексы SnF 3 - , Sn 2 F 5 - и SnF.2 (ОН 2 ). [14] Кристаллизация из водного раствора, содержащего NaF, дает соединения, содержащие полиядерные анионы, например NaSn 2 F 5 или Na 4 Sn 3 F 10 в зависимости от условий реакции, а не NaSnF 3 . [8] Соединение NaSnF 3 , содержащее пирамидальный анион SnF 3 - , может быть получено из раствора пиридин-вода. [15] Известны и другие соединения, содержащие пирамидальный анион SnF 3 - , например Ca (SnF 3 ) 2.. [16]
Уменьшение свойств [ править ]
SnF 2 представляет собой восстановитель со стандартным восстановительным потенциалом E o (Sn IV / Sn II ) = +0,15 В. [17] Растворы в HF легко окисляются рядом окислителей (O 2 , SO 2 или F 2 ) с образованием соединения смешанной валентности Sn 3 F 8 (содержащего Sn II и Sn IV и не содержащего связей Sn – Sn). [8]
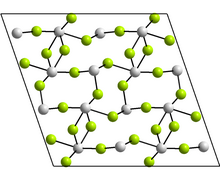
Структура [ править ]
Моноклинная форма содержит тетрамеры Sn 4 F 8 , в которых существует два различных координационных окружения для атомов Sn. В каждом случае есть три ближайших соседа: Sn находится на вершине тригональной пирамиды, а неподеленная пара электронов стерически активна. [18] Другие формы имеют структуры GeF 2 и парателлурита . [18]
Молекулярный SnF 2 [ править ]
В паровой фазе SnF 2 образует мономеры, димеры и тримеры. [14] Мономерный SnF 2 представляет собой нелинейную молекулу с длиной связи Sn-F 206 пм. [14] Сообщалось о комплексах SnF 2 , иногда называемых дифторстанниленом, с алкином и ароматическими соединениями, осажденными в матрице аргона при 12 К. [19] [20]
Безопасность [ править ]
Фторид олова может вызвать покраснение и раздражение при вдыхании или попадании в глаза. При острой дозе (более 2 мг / м 3 ) при проглатывании может вызвать боли в животе и шок. [21] Возможны редкие, но серьезные аллергические реакции; Симптомы включают зуд, отек и затрудненное дыхание. При использовании в стоматологических продуктах также может наблюдаться легкое обесцвечивание зубов ; это можно удалить щеткой. [22]
Ссылки [ править ]
- ^ a b «Национальный зал славы изобретателей объявляет призывников 2019 года на выставке CES» . Национальный зал славы изобретателей . Проверено 6 февраля 2019 .
- ^ "Латинские названия металлов с переменным зарядом" . Nobel.SCAS.BCIT.ca/ . Химический факультет Технологического института Британской Колумбии . Проверено 16 июня 2013 года .
- ^ Groeneveld, A .; Пурделл-Льюис, диджей; Арендс, Дж. (1976). «Реминерализация искусственных поражений кариеса фторидом олова». Исследование кариеса . 10 (3): 189–200. DOI : 10.1159 / 000260201 . ISSN 0008-6568 . PMID 1063601 .
- ^ Хаттаб, F. (апрель 1989). «Состояние фторидов в зубных пастах». Журнал стоматологии . 17 (2): 47–54. DOI : 10.1016 / 0300-5712 (89) 90129-2 . PMID 2732364 .
- ^ Nevitt Г.А., Witter DH, Bowman WD (сентябрь 1958). «Актуальные применения фторида натрия и фторида олова» . Общественный Rep здоровья . 73 (9): 847–50. DOI : 10.2307 / 4590256 . JSTOR 4590256 . PMC 1951625 . PMID 13579125 .
- ^ Перлих, Массачусетс; Бакка, штат Луизиана; Bollmer, BW; Lanzalaco, AC; Маккланахан, Сан-Франциско; Sewak, LK; Бейсвангер, BB; Эйхольд, Вашингтон; и другие. (1995). «Клинический эффект стабилизированной зубной пасты с фторидом олова на образование зубного налета, гингивит и кровоточивость десен: шестимесячное исследование». Журнал клинической стоматологии . 6 (специальный выпуск): 54–58. PMID 8593194 .
- ^ Lippert F, Newby EE, Lynch RJ, Чаухан В.К., Schemehorn BR (2009). «Лабораторная оценка противокариесного потенциала нового средства для ухода за зубами». J Clin Dent . 20 (2): 45–9. PMID 19591336 .
- ^ a b c Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Себи Ф., Потен-Готье М., Гиффо Э., Донар OFX; Потен-Готье; Гиффо; Донард (2001). «Критический обзор термодинамических данных для неорганических разновидностей олова». Geochimica et Cosmochimica Acta . 65 (18): 3041–3053. Bibcode : 2001GeCoA..65.3041S . DOI : 10.1016 / S0016-7037 (01) 00645-7 .CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Дэвид Б. Трой, 2005, Ремингтон: Наука и практика фармации , Lippincott Williams & Wilkins, ISBN 0-7817-4673-6 , ISBN 978-0-7817-4673-1
- ^ Denes G; Lazanas G .; Лазанас (1994). «Окисление фторида олова SnF 2 в водных растворах». Сверхтонкие взаимодействия . 90 (1): 435–439. Bibcode : 1994HyInt..90..435D . DOI : 10.1007 / BF02069152 . S2CID 96184099 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Chung Chun Hsu & RA Geanangel (1977). «Синтез и исследование аддуктов триметиламина с галогенидами олова (II)». Неорг. Chem . 16 (1): 2529–2534. DOI : 10.1021 / ic50176a022 .
- ^ Chung Chun Hsu & RA Geanangel (1980). «Донорное и акцепторное поведение соединений двухвалентного олова». Неорг. Chem . 19 (1): 110–119. DOI : 10.1021 / ic50203a024 .
- ^ a b c Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5 .
- ^ Салями TO, Zavalij PY и Оливер SRJ (2004). «Синтез и кристаллическая структура двух материалов фторида олова: NaSnF 3 (БИНГ-12) и Sn 3 F 3 PO 4 ». Журнал химии твердого тела . 177 (3): 800–805. Bibcode : 2004JSSCh.177..800S . DOI : 10.1016 / j.jssc.2003.09.013 .
- ^ Кокунов Ю.В.; Детков Д.Г .; Горбунова Ю. E .; Ершова М.М.; Михайлов Ю. Н. (2001). «Синтез и кристаллическая структура трифторстанната кальция (II)». Доклады Химия . 376 (4–6): 52–54. DOI : 10,1023 / A: 1018855109716 . S2CID 91430538 .
- ^ Housecroft, CE; Шарп, AG (2004). Неорганическая химия (2-е изд.). Прентис Холл. ISBN 978-0-13-039913-7.
- ^ a b Уэллс А.Ф. (1984) Структурная неорганическая химия, 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ↑ С.Е. Боганов, В.И. Фаустов, М.П. Егоров, О.М. Нефедов (1994). «Матричные ИК-спектры и квантово-химические исследования реакции между дифторстанниленом и гепт-1-ином. Первое прямое наблюдение π-комплекса карбенового аналога с алкином». Российский химический вестник . 43 (1): 47–49. DOI : 10.1007 / BF00699133 . S2CID 97064510 . CS1 maint: несколько имен: список авторов ( ссылка )
- ↑ С.Е. Боганов, М.П. Егоров, О.М. Нефедов (1999). «Изучение комплексообразования между дифторстанниленом и ароматическими соединениями с помощью матричной ИК-спектроскопии». Российский химический вестник . 48 (1): 98–103. DOI : 10.1007 / BF02494408 . S2CID 94004320 .
- ^ «Фторид олова (ICSC: 0860)» . CDC: Международные карты химической безопасности . Проверено 11 марта 2014 года .
- ^ "Стоматологический фторид олова" . WebMD . Проверено 11 марта 2014 года .
