Этот раздел требует дополнительных ссылок для проверки . ( Июнь 2012 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Дирениум, другие |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a682337 |
Категория беременности |
|
| Пути администрирования | Устно |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетические данные | |
| Биодоступность | 30–70% |
| Связывание с белками | 67% |
| Метаболизм | гидроксилирование до пара-гидрокситриамтерена |
| Ликвидация Период полураспада | 1-2 часа, активный метаболит 3 часа |
| Экскреция | почек <50%, 21% без изменений |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| CompTox Dashboard ( EPA ) |
|
| ECHA InfoCard | 100.006.278 |
| Химические и физические данные | |
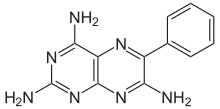
| Формула | C 12 H 11 N 7 |
| Молярная масса | 253,269 г · моль -1 |
ИнЧИ
| |
| | |
Триамтерен ( среди прочего, торговое название Dyrenium ) представляет собой калийсберегающий диуретик, который часто используется в сочетании с тиазидными диуретиками для лечения высокого кровяного давления или отека . Комбинация с гидрохлоротиазидом известна как гидрохлоротиазид / триамтерен .
Побочные эффекты [ править ]
Общие побочные эффекты могут включать снижение уровня натрия , фолиевой кислоты и кальция , тошноту, рвоту, диарею, головную боль, головокружение, утомляемость и сухость во рту. Серьезные побочные эффекты могут включать учащенное сердцебиение, покалывание / онемение, лихорадку, озноб, боль в горле, сыпь и боль в спине. Триамтерен также может вызывать образование камней в почках в результате прямой кристаллизации или посева камней оксалата кальция . Триамтерен лучше избегать пациентам с хроническим заболеванием почек из-за возможности гиперкалиемии . Людям, принимающим этот препарат, следует осторожно использовать заменители соли . [1]
Триамтерен может придавать мочу флуоресцентный синий цвет.
Осторожно при определенных болезненных состояниях [ править ]
Диабет : используйте с осторожностью у людей с преддиабетом или сахарным диабетом, так как может наблюдаться изменение контроля уровня глюкозы.
Нарушение функции печени : применять с осторожностью людям с тяжелым нарушением функции печени; при циррозе следует избегать дисбаланса электролитов и кислот / оснований, которые могут привести к печеночной энцефалопатии .
Почечная недостаточность : комбинированная терапия триамтереном и индометацином у некоторых людей вызвала обратимое острое повреждение почек . [2]
Камни в почках : использовать с осторожностью у людей с камнями в почках.
Следует избегать использования, если клиренс креатинина менее 10 мл / мин.
Механизм действия [ править ]
Триамтерен напрямую блокирует эпителиальный натриевый канал [3] (ENaC) на стороне просвета собирающего канальца почки . [4] : 127 Другие диуретики вызывают снижение концентрации натрия в образующейся моче из-за поступления натрия в клетку через ENaC и одновременного выхода калия из основной клетки в образующуюся мочу. Блокировка ENaC предотвращает это. Амилорид действует точно так же. Блокаторы натриевых каналов напрямую препятствуют поступлению натрия в натриевые каналы.
С гидрохлоротиазидом [ править ]
Триамтерен обычно готовят в комбинации с гидрохлоротиазидом для лечения гипертонии (высокого кровяного давления) и отеков (задержки воды). Эта комбинация относится к классу лекарств, называемых диуретиками или «водными таблетками», и заставляет почки избавляться от ненужной воды и натрия в организме через мочу . [5]
История [ править ]
Кольцевая система триамтерена содержится во многих природных соединениях, таких как фолиевая кислота и рибофлавин. Наблюдение за тем, что встречающийся в природе ксантоптерин оказывает почечное воздействие, побудило ученых из Smith Kline и French Laboratories в Филадельфии начать кампанию в области медицинской химии для обнаружения потенциальных лекарств в рамках программы по открытию калийсберегающих диуретиков. [4] : 125 Первые клинические исследования были опубликованы в 1961 году, а первые исследования, в которых он сочетается с гидрохлоротиазидом, были опубликованы в следующем году. [4] : 126 [6] [7]
Smith Kline & French запустила его в качестве единственного агента под брендом Dyrenium в 1964 году [8] : 83 комбинированный препарат с hydrochlorothiazidem, Dyazide, был впервые одобрен в США в 1965 году , а первом общем, привезенный Болар Pharmaceutical Co., был одобрен в 1987 году. [9] [10] В 1986 году Dyazide был наиболее прописываемым препаратом в США, и его продажи составили 325 миллионов долларов, что сделало его вторым по величине продавцом SmithKline Beckman после Tagamet . [10]
Срок действия патентов на Dyazide истек в 1980 году, но возникли сложности с введением дженериков, поскольку состав Dyazide приводил к разным партиям, из-за чего производители дженериков не могли доказать, что их версии были биоэквивалентны. [11] [12]
Компания Bolar Pharmaceutical пыталась первой предложить дженерик, но его применение было отложено из-за опасений по поводу того, обеспечивает ли его состав одинаковое количество каждого препарата; они были осложнены обвинениями в том, что Болар обманным путем заменил Dyazide своей собственной версией для проведения исследований, которые были представлены в FDA. [10] Вскоре после того, как дженерик Болара был одобрен, были высказаны дальнейшие опасения в отношении приложений Болара к рынку дженериков в целом; Эти результаты, среди прочего, вызвали широкую обеспокоенность среди врачей и общественности по поводу того, действительно ли дженерики аналогичны брендированным лекарствам. [13] [14] Болар в итоге отозвал родовую форму диазида и отозвал этот продукт в 1990 году. [15] В 1991 году Министерство юстиции США от имени FDA предъявило Болару 20 уголовных обвинений в мошенничестве [16], а в начале следующего года Болар признал себя виновным и согласился выплатить штраф в размере 10 миллионов долларов. [17] Обеспокоенность общественности безопасностью непатентованных лекарств усугубилась расследованием Конгресса фактов взяточничества в FDA со стороны компаний-производителей дженериков, которые обнаружили повсеместную коррупцию; расследование было инициировано компанией по производству дженериков Mylan , которая наняла частных исследователей, основываясь на своем убеждении, что конкуренты получают несправедливые преимущества в получении одобрения своих генериков. [18]
Майлан сама разработала версию комбинированного препарата триамтерен / гидрохлоротиазид после того, как патент Dyazide истек, и используется другой, более стабильной композиции [12] , а также различные дозы каждого активного ингредиента (50 мг Гидрохлоротиазид и 75 мг триамтерен, по сравнению с Dyazide - х 25 мг гидрохлоротиазида и 50 мг триамтерена), поэтому он должен был получить одобрение как новый препарат, а не дженерик; их продукт назывался Maxzide и был одобрен в 1984 году. [19] [20] Более высокая доза, разрешенная один раз в день, которая, по мнению Mylan и ее маркетингового партнера, Lederle, поможет ей конкурировать с Dyazide, продажи которой составляли 210 миллионов долларов. 1983. [20]
Патенты Mylan на препарат были признаны недействительными в суде, а его исключительные права на маркетинг истекли в 1987 году, что вызвало всплеск конкуренции со стороны дженериков и судебных разбирательств между ними, American Therapeutics Inc. и Vitarine Pharmaceuticals, с FDA. [21] Vitarine, наряду с Par Pharmaceutical , были двумя компаниями, на которые Милан нацелился в своем расследовании коррупции, и оказалось, что Par и Vitarine использовали Maxzide Mylan для получения данных о своей биоэквивалентности, что вынудило обе компании отозвать свой генерик. конкурент продукта Mylan. [18] [22] Дженерики в конечном итоге вышли на рынок. [23]
Исследование [ править ]
В то время как отсутствуют рандомизированные контролируемые испытания, оценивающие использование триамтерена для лечения болезни Меньера , типичное лечение составляет 37,5 мг триамтерена с 25 мг гидрохлоротиазида по 1-2 капсулы в день. [24] [25] Этой рекомендации была присвоена степень C. Классификация силы рекомендаций (SORT) C. [ необходима ссылка ]
Ссылки [ править ]
- ^ LoSalt Advisory Заявление (PDF) архивации 10 декабря 2005, в Wayback Machine
- ^ Фавр, L; Glasson, P; Валлотон, МБ (1982). «Обратимая острая почечная недостаточность от комбинированного триамтерена и индометацина: исследование на здоровых людях». Ann Intern Med . 96 (3): 317–20. DOI : 10.7326 / 0003-4819-96-3-317 . PMID 6949485 .
- ^ Busch AE, Suessbrich H, Kunzelmann K, Hipper A, Greger R, Waldegger S и др. (Сентябрь 1996 г.). «Блокада эпителиальных Na + -каналов триамтеренами - основные механизмы и молекулярная основа». Pflugers Archiv . 432 (5): 760–6. DOI : 10.1007 / s004240050196 . PMID 8772124 .
- ^ a b c Финк CA, Маккенна Дж. М., Вернер Л. Х. (2003). «Мочегонные и урикозурические средства». В Abraham DJ (ред.). Лечебная химия Бургера и открытие лекарств. Том 3: Сердечно-сосудистые агенты и эндокрины (6-е изд.). Вайли. С. 55–154. ISBN 978-0471370291.
- ^ «Триамтерен и гидрохлоротиазид» . MedlinePlus. Национальная медицинская библиотека США . Национальные институты здоровья . 1 сентября 2008 г.
- ^ Crosley А.П., Ронкильо Л.М., Стрикленд WH, Александр F (февраль 1962). «Триамтерен, новое натруретическое средство. Предварительные наблюдения на человеке». Анналы внутренней медицины . 56 (2): 241–51. DOI : 10.7326 / 0003-4819-56-2-241 . PMID 13882367 .
- ^ Heath WC, Freis ED (октябрь 1963). «Триамтерен с гидрохлоротиазидом в лечении гипертонии». JAMA . 186 (2): 119–22. DOI : 10.1001 / jama.1963.03710020039012 . PMID 14056525 .
- ^ Ландау R, Achilladelis В, Скрябин А (1999). Фармацевтические инновации: революция в здоровье человека . Серия «Фонд химического наследия» в области инноваций и предпринимательства. 2 . Фонд химического наследия. ISBN 9780941901215.
- ^ История утверждения FDA NDA 016042: Dyazide . Доступ к странице: 8 сентября 2016 г.
- ^ a b c Рон Вольф для The Philadelphia Inquirer . 22 августа 1987 г. Смитклайн теряет исключительные права на наркотики.
- Перейти ↑ Boehm G, Yao L, Han L, Zheng Q (сентябрь 2013 г.). «Развитие производства непатентованных лекарств в США после принятия Закона Хэтча-Ваксмана 1984 года» . Acta Pharmaceutica Sinica Б . 3 (5): 297–311. DOI : 10.1016 / j.apsb.2013.07.004 .
- ^ а б Моряк Дж, Лэндри Дж. Т. (2011). Mylan 50 лет нетрадиционного успеха . Университетское издательство Новой Англии. п. 50. ISBN 9781611682700.
- ↑ Стрикленд C (15 октября 1989 г.). "Болар: наркокомпания в осаде" . Нью-Йорк Таймс .
- ^ Cimons M (29 августа 1989). «FDA поднимет ОК последней дженериковой версии Dyazide» . Лос-Анджелес Таймс .
- ^ «Болар отзывает родовую версию диазида и фенитоина с расширенным высвобождением, говоря, что« биоэквивалентность не может быть гарантирована »; продукты; составляют 52% продаж» . Розовый лист . 5 февраля 1990 г.
- ↑ Shaw D (27 февраля 1991 г.). «Мы обвиняем Bolar Pharmaceutical в искажении сведений о своей продукции» . The Philadelphia Inquirer .
- ^ Freudenheim M (28 февраля 1991). "Болар планирует признание вины в отношении генериков" . Нью-Йорк Таймс .
- ^ a b Freudenheim M (10 сентября 1989 г.). «Разоблачение FDA» The New York Times .
- ^ FDA одобрение История NDA 019129: Maxzide Page доступ8 сентября 2016
- ^ a b Pink Sheet 22 октября 1984 г. Максзид Майлана "одобрен" Управлением по контролю за продуктами и лекарствами: конкуренция бренда Lederle на рынке с Dyazide, занимающим 3-е место в Smithkline; Окончательное одобрение ожидается "неизбежно"
- Перейти ↑ Reid K (17 ноября 1987 г.). «Судья США выносит постановление о маркетинге лекарств» . Журнал коммерции.
- ↑ Эндрюс Э.Л. (31 июля 1989 г.). «Запрос FDA по непатентованным лекарственным средствам фокусируется на изменениях в ингредиентах» . Нью-Йорк Таймс .
- ^ СтраницаDrugs.com Generic Maxzide, доступ 8 сентября 2016 г.
- ^ Swartz R, Longwell P (март 2005). «Лечение головокружения» (PDF) . Американский семейный врач . 71 (6): 1115–22. PMID 15791890 .
- ^ Sloane PD, Coeytaux RR, RS Бек, Dallara J (май 2001). «Головокружение: состояние науки». Анналы внутренней медицины . 134 (9 Pt 2): 823–32. DOI : 10.7326 / 0003-4819-134-9_Part_2-200105011-00005 . PMID 11346317 .