Винилогия - это передача электронных эффектов через систему сопряженных органических соединений. [1] Эта концепция была введена в 1926 году Людвигом Клайзеном для объяснения кислотных свойств формилацетона и родственных кетоальдегидов. [2] Его прилагательная форма, винилогия , используется для описания функциональных групп, в которых стандартные фрагменты группы разделены двойной углерод-углеродной связью. Например, карбоновая кислота с двойной связью углерод-углерод (-HC = CH-, « виниловая » группа; фактически виниленовая группа) между карбонильной группой и гидроксильной группой.группа упоминается как винилогистая карбоновая кислота .
Благодаря передаче электронной информации посредством конъюгации винилогичные функциональные группы часто обладают « аналогичной » реакционной способностью или химическими свойствами по сравнению с исходной функциональной группой. Следовательно, винилогия является полезной эвристикой для предсказания поведения систем, которые структурно подобны, но содержат промежуточные связи C = C, которые сопряжены с присоединенными функциональными группами. Например, ключевым свойством карбоновых кислот является их кислотность по Бренстеду. Простейшая карбоновая кислота, муравьиная кислота (HC (= O) –OH), представляет собой умеренно сильную органическую кислоту с ap K aиз 3.7. Мы ожидаем, что винилогичные карбоновые кислоты будут иметь аналогичную кислотность. В самом деле, винилог муравьиной кислоты, 2-формил-1-этен-1-ола, HC (= O) –CH = CH – OH, имеет значительную кислотность по Бренстеду с расчетным p K a ~ 5–6. В частности, винилогенные карбоновые кислоты являются значительно более сильными кислотами, чем типичные енолы (p K a ~ 12). Витамин С ( аскорбиновая кислота , см. Ниже ) является биологически важным примером винилогенной карбоновой кислоты.
Введение о- или п- фенилена (т. Е. Бензольного кольца в 1,2- или 1,4-ориентации) также приводит к некоторому сходству в реакционной способности (так называемой «фенилогии»), хотя эффект обычно слабее, поскольку конъюгация через арильное кольцо требует рассмотрения резонансных форм или промежуточных соединений, в которых нарушена ароматичность. [3] [4]

Винилогенная реактивность [ править ]
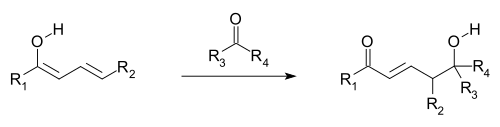
Полагают, что винилогические реакции происходят, когда орбитали двойных связей винильной группы и присоединенной электроноакцепторной группы (EWG; π-орбитали) выровнены и поэтому могут перекрываться и смешиваться (т. Е. Сопряжены ). Делокализация электронов позволяет EWG получать электронную плотность за счет участия сопряженной системы. Виниловые реакции , также включают сопряженные дополнения , где Нуклеофильные реагирует на виниловом конце, а также Виниловое изменение альдольной реакции , где электрофильного подвергается нападению нуклеофильного винилогенного енолята(см. первое и следующее изображение). Винилогичный енолят реагирует в конечном положении системы двойных связей (γ-углерод), а не α-углерод, непосредственно примыкающий к карбонилу, как простой енолят. Аллильные электрофилы часто реагируют винилогичной атакой нуклеофила, а не прямым присоединением.
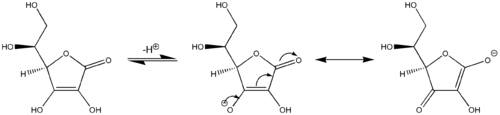
Еще один пример винилогической реакционной способности: аскорбиновая кислота (витамин С) ведет себя как винилогенная карбоновая кислота за счет участия ее карбонильной части, винильной группы внутри кольца и неподеленной пары на гидроксильной группе, действующей как сопряженная система . Кислотность гидроксильного протона на конце винильной группы в аскорбиновой кислоте более сопоставима с типичной карбоновой кислотой, чем со спиртом, потому что две основные резонансные структуры стабилизируют отрицательный заряд на основе конъюгата.аскорбиновой кислоты (центральная и правая структуры на последнем изображении), аналогичные двум резонансным структурам, которые стабилизируют отрицательный заряд на анионе, который возникает в результате удаления протона из простой карбоновой кислоты (см. первое изображение). Аналогично, производные сорбиновой кислоты , расширенные другим «винильным» фрагментом, также проявляют винилогичное поведение.
Дальнейшее чтение [ править ]
- Лиссабон, Марилда П .; Hoang, Tung T .; Дадли, Грегори Б. (2011). «Тандемное нуклеофильное добавление / фрагментация винилогенных ацилтрифлатов: 2-метил-2- (1-оксо-5-гептинил) -1,3-дитиан» . Органический синтез . 88 : 353. DOI : 10,15227 / orgsyn.088.0353 .
Ссылки [ править ]
- ^ Реакция винилогичного альдола: ценный, но заниженный маневр образования углерод-углеродных связей Джованни Казираги, Франка Занарди, Джованни Аппендино и Глория Рассу Chem. Rev. 2000 ; 100 (6) стр. 1929–1972; (Обзор) doi : 10.1021 / cr990247i
- ^ Zu den O-Alkylderivaten des Benzoyl-acetons und den aus ihnen entstehenden Isoxazolen. (Entgegnung an Hrn. O. Weygand.) Berichte der deutschen chemischen Gesellschaft (серии A и B) Том 59, выпуск 2, дата: 10 февраля 1926 г., страницы: 144-153 L. Claisen. DOI : 10.1002 / cber.19260590206
- ^ Ямасаки, Рю; Икеда, Хирокадзу; Масу, Хьюма; Адзумая, Исао; Сайто, Шиничи (2012-10-07). «Синтез и свойства фениловых амидов» . Тетраэдр . 68 (40): 8450–8456. DOI : 10.1016 / j.tet.2012.07.084 . ISSN 0040-4020 .
- ^ Лоуренс, Энтони Дж .; Хатчингс, Майкл Дж .; Кеннеди, Алан Р .; Макдуалл, Джозеф Дж. В. (05.02.2010). «Бензодифурантрион: стабильный фенилогенный енол» . Журнал органической химии . 75 (3): 690–701. DOI : 10.1021 / jo9022155 . ISSN 0022-3263 .