| Имена | |||
|---|---|---|---|
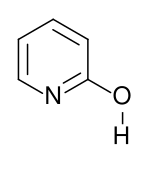
| Предпочтительное название IUPAC Пиридин-2 (1 H ) -он | |||
| Другие названия 2 (1 H ) -пиридинон 2 (1 H ) -пиридон 1 H- пиридин-2-он 2-пиридон 1,2-дигидро-2-оксопиридин 1 H -2-пиридон 2-оксопиридон 2-пиридинол 2-гидроксипиридин | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.019 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| C 5 H 5 N O | |||
| Молярная масса | 95,101 г · моль -1 | ||
| Появление | Бесцветное кристаллическое твердое вещество | ||
| Плотность | 1,39 г / см³ | ||
| Температура плавления | 107,8 ° С (226,0 ° F, 380,9 К) | ||
| Точка кипения | 280 ° С (536 ° F, 553 К) разл. | ||
| Растворимость в других растворителях | Растворим в воде , метаноле , ацетоне. | ||
| Кислотность (p K a ) | 11,65 | ||
| УФ-видимый (λ макс. ) | 293 нм (ε 5900, раствор H 2 O) | ||
| Состав | |||
| Орторомбический | |||
| планарный | |||
| 4,26 D | |||
| Опасности | |||
| Основные опасности | раздражающий | ||
| Паспорт безопасности | См .: страницу данных | ||
| Пиктограммы GHS | |||
| Сигнальное слово GHS | Опасность | ||
Положения об опасности GHS | H301 , H315 , H319 , H335 | ||
Меры предосторожности GHS | Р261 , Р264 , Р270 , Р271 , Р280 , Р301 + 310 , P302 + 352 , Р304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | ||
| NFPA 704 (огненный алмаз) |  2 1 | ||
| точка возгорания | 210 ° С (410 ° F, 483 К) | ||
| Родственные соединения | |||
Другие анионы | 2-пиридинолат | ||
Другие катионы | 2-гидроксипиридиний-ион | ||
Связанные функциональные группы | спирт , лактам , лактим , пиридин , кетон | ||
Родственные соединения | пиридин , тимин , цитозин , урацил , бензол | ||
| Страница дополнительных данных | |||
Структура и свойства | Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | ||
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ | ||
Спектральные данные | УФ , ИК , ЯМР , МС | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
2-Пиридон представляет собой органическое соединение с формулой C
5ЧАС
4NH (O) . Это бесцветное твердое вещество. Хорошо известно образование димеров с водородными связями, и это также классический случай соединения, которое существует в виде таутомеров .
Таутомерия [ править ]
Второй таутомер - 2-гидроксипиридин. Этот лактам лактимная таутомерия также может проявляться во многих родственных соединениях. [1]
Таутомерия в твердом состоянии [ править ]
Амидная группа может быть вовлечена в водородной связи с другим азотом - и кислород отработанных видов.
Преобладающая форма твердого состояния - 2-пиридон. Это было подтверждено рентгеновской кристаллографией, которая показывает, что водород в твердом состоянии ближе к азоту, чем к кислороду (из-за низкой электронной плотности у водорода точное позиционирование затруднено), и ИК-спектроскопии , которая показывает что продольная частота C = O присутствует, а частоты OH отсутствуют. [2] [3] [4] [5]
Таутомерия в растворе [ править ]
Определение того, какая из двух таутомерных форм присутствует в растворе , было предметом многих публикаций. Разность энергий по- видимому, очень мала и зависит от полярности этого растворителя . Неполярные растворители способствуют образованию 2-гидроксипиридина, тогда как полярные растворители, такие как спирты и вода, способствуют образованию 2-пиридона. [1] [6] [7] [8] [9] [10] [11] [12] [13]
Разница энергий для двух таутомеров в газовой фазе, измеренная с помощью ИК-спектроскопии, составляла от 2,43 до 3,3 кДж / моль для твердого состояния и 8,95 кДж / моль и 8,83 кДж / моль для жидкого состояния. [14] [15] [16]
Механизм таутомеризации A [ править ]
Таутомеризация одиночных молекул имеет запрещенные 1-3 надфазные переходные состояния и, следовательно, имеет высокий энергетический барьер для этой таутомеризации , который был рассчитан теоретическими методами и составлял 125 или 210 кДж / моль. Прямая таутомеризация энергетически не приветствуется. Есть и другие возможные механизмы этой таутомеризации. [16]
Димеризация [ править ]
2-Пиридон и 2-гидроксипиридин могут образовывать димеры с двумя водородными связями. [17]
Агрегация в твердом состоянии [ править ]
В твердом состоянии димерная форма отсутствует; 2-пиридоны образуют спиральную структуру по водородным связям. Некоторые замещенные 2-пиридоны образуют димер в твердом состоянии, например 5-метил-3-карбонитрил-2-пиридон. Определение всех этих структур было выполнено с помощью рентгеновской кристаллографии . В твердом состоянии водород расположен ближе к кислороду, поэтому можно считать правильным называть бесцветные кристаллы в колбе 2-пиридоном. [1] [2] [3] [4] [5]
Агрегация в растворе [ править ]
В растворе присутствует димерная форма; степень димеризации сильно зависит от полярности растворителя. Полярные и протонные растворители взаимодействуют с водородными связями, и образуется больше мономера . Гидрофобные эффекты в неполярных растворителях приводят к преобладанию димера. Соотношение таутомерных форм также зависит от растворителя. Все возможные таутомеры и димеры могут присутствовать и образовывать равновесие, и точное измерение всех констант равновесия в системе чрезвычайно сложно. [17] [18] [19] [20] [21] [22] [23] [24] [25] [26]
( ЯМР-спектроскопия - медленный метод, ИК-спектроскопия высокого разрешения в растворителе затруднена, широкое поглощение в УФ-спектроскопии затрудняет различение 3 и более очень похожих молекул ).
Некоторые публикации сосредотачиваются только на одном из двух возможных паттернов и игнорируют влияние другого. Например, вычисление разности энергий двух таутомеров в неполярном растворе приведет к неверному результату, если большое количество вещества находится на стороне димера в состоянии равновесия.
Механизм таутомеризации B [ править ]
Прямая таутомеризация не является энергетически благоприятной, но димеризация с последующим двойным переносом протона и диссоциацией димера является самокаталитическим путем от одного таутомера к другому. Протонные растворители также обеспечивают перенос протонов во время таутомеризации.
Синтез [ править ]
2-Пирон может быть получен реакцией циклизации и превращен в 2-пиридон посредством реакции обмена с аммиаком :
Пиридин образует N- оксид с некоторыми окислителями, такими как перекись водорода . Этот пиридин- N- оксид подвергается реакции перегруппировки в 2-пиридон в уксусном ангидриде : [27] [28] [29]
При конденсации Гуарески-Торпа цианоацетамид реагирует с 1,3-дикетоном до 2-пиридона . [18] [19] Реакция названа в честь Исилио Гуарески и Джоселин Филд Торп . [20] [21]
Химические свойства [ править ]
Каталитическая активность [ править ]
2-Пиридон катализирует множество протон-зависимых реакций, например аминолиз сложных эфиров. В некоторых случаях в качестве растворителя используется расплавленный 2-пиридон. Мутаротация сахаров и что 2-пиридон оказывают большое влияние на реакции от активированных эфиров с аминами в неполярном растворителе , который приписывает его таутомеризацию и полезность в качестве ditopic рецептора. Текущий интерес сосредоточен на переносе протона от 2-пиридона и его таутомера с использованием изотопного мечения , кинетики и квантово-химических методов для определения стадии, определяющей скорость в механизме реакции. [22] [23] [30]
Координационная химия [ править ]
2-Пиридон и некоторые производные служат лигандами в координационной химии, обычно как 1,3-мостиковый лиганд, родственный карбоксилату . [24]
В природе [ править ]
2-Пиридон не встречается в природе, но его производное было выделено в качестве кофактора в некоторых гидрогеназах . [25]
Экологическое поведение [ править ]
2-Пиридон быстро разлагается микроорганизмами в почвенной среде с периодом полураспада менее одной недели. [26] Организмы, способные расти на 2-пиридоне в качестве единственного источника углерода, азота и энергии, были выделены рядом исследователей. Наиболее широко изучены 2-пиридон degrader является грамположительной бактерией Arthrobacter crystallopoietes , [31] член филюмом Actinobacteriaкоторый включает множество родственных организмов, которые, как было показано, разлагают пиридин или один или несколько алкил-, карбоксил- или гидроксилзамещенных пиридинов. Разложение 2-пиридона обычно инициируется атакой монооксигеназы, в результате чего образуется диол, такой как 2,5-дигидроксипиридин, который метаболизируется через малеаматный путь. Деление кольца происходит под действием 2,5-дигидроксипиридинмонооксигеназы, которая также участвует в метаболизме никотиновой кислоты через малеаматный путь. В случае Arthrobacter crystallopoietes , по крайней мере, часть пути деградации связана с плазмидами. [32] Пиридиндиолы подвергаются химическому превращению в растворе с образованием ярко окрашенных пигментов. Подобные пигменты наблюдались при разложении хинолина ,[33] также из-за трансформации метаболитов, однако желтые пигменты, о которых часто сообщается при разложении многих пиридиновых растворителей, таких как незамещенный пиридин или пиколин , обычно возникают в результате перепроизводства рибофлавина в присутствии этих растворителей. [34] Вообще говоря, разложение пиридонов, дигидроксипиридинов и пиридинкарбоновых кислот обычно опосредуется оксигеназами, тогда как разложение пиридиновых растворителей часто не происходит, и в некоторых случаях может включать начальную стадию восстановления. [32]
См. Также [ править ]
- 2-Пиридон (страница данных)
- 2-пирон
- 4-пиридон
- 5-метил-2-пиридон используется для производства пирфенидона .
Ссылки [ править ]
- ^ a b c Форлани Л .; Cristoni G .; Boga C .; Todesco PE; Del Vecchio E .; Selva S .; Монари М. (2002). «Повторное исследование таутомерии некоторых замещенных 2-гидроксипиридинов» . Arkivoc . XI (11): 198–215. DOI : 10,3998 / ark.5550190.0003.b18 .[ постоянная мертвая ссылка ]
- ^ а б Ян Х.В. Крейвен Б.М. (1998). «Плотность заряда 2-пиридона» . Acta Crystallogr. B . 54 (6): 912–920. DOI : 10.1107 / S0108768198006545 . PMID 9880899 .
- ^ а б Пенфолд Б. Р. (1953). «Распределение электронов в кристаллическом альфа-пиридоне». Acta Crystallogr . 6 (7): 591–600. DOI : 10.1107 / S0365110X5300168X .
- ^ a b Ом U .; Guth H .; Heller E .; Dannöhl H .; Швейг А. (1984). «Сравнение наблюдаемой и рассчитанной электронной плотности 2-пиридона, C 5 H 5 NO, уточнения кристаллической структуры при 295 К и 120 К, экспериментальные и теоретические исследования плотности деформации». Z. Kristallogr . 169 : 185–200. DOI : 10.1524 / zkri.1984.169.14.185 . S2CID 97575334 .
- ^ a b Almlöf J .; Kvick A .; Оловссон И. (1971). «Изучение водородной связи кристаллической структуры межмолекулярного комплекса 2-пиридон-6-хлор-2-гидроксипиридин» . Acta Crystallogr. B . 27 (6): 1201–1208. DOI : 10.1107 / S0567740871003753 .
- ^ Vögeli U .; фон Филипсборн В. (1973). «C-13 и H-1 ЯМР-спектроскопические исследования структуры N-метил-3-пиридона и 3-гидройпиридина». Org Magn Reson . 5 (12): 551–559. DOI : 10.1002 / mrc.1270051202 .
- ^ Specker H .; Гаврош Х. (1942). «Ультрафиолетовое поглощение бензтриаксола, приридона и его солей». Chem. Бер. (75): 1338–1348. DOI : 10.1002 / cber.19420751115 .
- ^ Leis DG; Курран BC (1945). «Электрические моменты некоторых гамма-замещенных пиридинов». Журнал Американского химического общества . 67 (1): 79–81. DOI : 10.1021 / ja01217a028 .
- ^ Альберт А .; Филлипс Дж. Н. (1956). "Константы ионизации гидроксипроизводных гетероциклических веществ азотистых шестичленных кольцевых соединений". J. Chem. Soc. : 1294–1304. DOI : 10.1039 / jr9560001294 .
- ^ Cox RH; Ботнер-Би А. А (1969). «Спектры протонного магнитного резонанса таутомерных замещенных пиридинов и их сопряженных кислот». J. Phys. Chem . 73 (8): 2465–2468. DOI : 10.1021 / j100842a001 .
- ^ Aksnes DW, Kryvi; Криви, Хакон; Самуэльсон, Олоф; Шёстранд, Элизабет; Свенссон, Зигфрид (1972). "Заместитель и растворитель эффекты в протонном магнитно-резонансном (PMR) спектрах 6 2-замещенных пиридинов" . Acta Chem. Сканд . 26 (26): 2255–2266. DOI : 10.3891 / acta.chem.scand.26-2255 .
- ^ Ауэ DH, Betowski LD, Davidson WR, Бауэр MT, клюв P (1979). «Основности амидов и имидатов в газовой фазе - оценка протомерных равновесий-констант методом основности в газовой фазе». Журнал Американского химического общества . 101 (6): 1361–1368. DOI : 10.1021 / ja00500a001 .
- ^ Франк Дж., Алан Р. Катрицки (1976). «Таутомерные пиридины. XV. Пиридон-гидроксипиридиновые равновесия в растворителях разной полярности». J. Chem Soc Perkin Trans 2 (12): 1428–1431. DOI : 10.1039 / p29760001428 .
- ^ Коричневый RS; Це А .; Ведерас JC (1980). "Фотоэлектро-определенные энергии связи ядра и прогнозируемые газофазные основы для 2-гидроксипиридин 2-пиридоновой системы". Журнал Американского химического общества . 102 (3): 1174–1176. DOI : 10.1021 / ja00523a050 .
- ^ Клюв П. (1977). «Энергия и алкилирование таутомерных гетероциклических соединений - старые проблемы - новые ответы». В соотв. Chem. Res. 10 (5): 186–192. DOI : 10.1021 / ar50113a006 .
- ^ a b Абдулла HI; Эль-Бермани М.Ф. (2001). «Инфракрасные исследования таутомерии в 2-гидроксипиридине, 2-тиопиридине и 2-аминопиридине». Spectrochimica Acta Часть A: Молекулярная и биомолекулярная спектроскопия . 57 (13): 2659–2671. Bibcode : 2001AcSpA..57.2659A . DOI : 10.1016 / S1386-1425 (01) 00455-3 . PMID 11765793 .
- ^ а б Хэммс Г.Г., Лилфорд П.Дж. (1970). "Кинетическое и равновесное исследование димеризации водородной связи 2-пиридона в растворителе водородной связи". Варенье. Chem. Soc. 92 (26): 7578–7585. DOI : 10.1021 / ja00729a012 .
- ^ a b Гилкрист, TL (1997). Гетероциклическая химия ISBN 0-470-20481-8
- ^ а б Рыбаков В.Р .; Буш А.А.; Бабаев Е.Б .; Асланов Л.А. (2004). «3-Циано-4,6-диметил-2-пиридон (пиридон Гуарески)». Acta Crystallogr E . 6 (2): o160 – o161. DOI : 10.1107 / S1600536803029295 .
- ^ а б И. Гуарески (1896). "Mem. Reale Accad. Sci. Torino II". 46, 7, 11, 25. Цитировать журнал требует
|journal=( помощь ) - ^ a b Барон, H .; Ремфрай, FGP; Торп, Дж. Ф. (1904). «CLXXV.-Образование и реакции иминосоединений. Часть I. Конденсация этилцианоацетата с его производным натрия» . J. Chem. Soc., Trans . 85 : 1726–1761. DOI : 10.1039 / ct9048501726 .
- ^ a b Fischer CB; Steininger H .; Стивенсон Д.С.; Зипсе Х. (2005). «Катализ аминолиза 4-нитрофенилацетата 2-пиридоном». Журнал физической органической химии . 18 (9): 901–907. DOI : 10.1002 / poc.914 .
- ^ а б Л.-Х. Ванга; Х. Зипсе (1996). «Бифункциональный катализ аминолиза сложных эфиров - вычислительное и экспериментальное исследование». Liebigs Ann . 1996 (10): 1501–1509. DOI : 10.1002 / jlac.199619961003 .[ мертвая ссылка ]
- ^ a b Rawson JM; Winpenny REP (1995). «Координационная химия 2-пиридонов и его производных». Обзоры координационной химии . 139 (139): 313–374. DOI : 10.1016 / 0010-8545 (94) 01117-Т .
- ^ a b Shima, S .; Lyon, EJ; Sordel-Klippert, M .; Kauss, M .; Kahnt, J .; Тауер, РК; Steinbach, K .; Се, X .; Verdier, L. и Griesinger, C., "Выяснение структуры: кофактор железо-серной кластерной гидрогеназы Hmd: структура продукта световой инактивации", Angew. Chem. Int. Ed., 2004, 43, 2547-2551.
- ^ a b Sims, Джеральд К .; S (1985). «Деградация производных пиридина в почве» . Журнал качества окружающей среды . 14 (4): 580–584. DOI : 10,2134 / jeq1985.00472425001400040022x . Архивировано из оригинала на 2008-08-30.
- ^ «Пиридин-N-оксид と 酸 無水 物 と の 反應» [Реакция между пиридин-N-оксидом и ангидридом кислоты]. Якугаку Дзасси (на японском языке). 67 (3–4): 51–52. 1947. DOI : 10,1248 / yakushi1947.67.3-4_51 .
- ^ Очиаи, Эйдзи. (1953). «Недавние японские работы по химии пиридин-1-оксида и родственных соединений». Журнал органической химии . 18 (5): 534–551. DOI : 10.1021 / jo01133a010 .
- ^ Boekelheide, V .; Лен, WL (1961). «Перегруппировка замещенных N-оксидов пиридина с уксусным ангидридом1.2». Журнал органической химии . 26 (2): 428–430. DOI : 10.1021 / jo01061a037 .
- ^ Fischer CB; Полборн К .; Steininger H .; Зипсе Х. (2004). «Синтез и твердотельные структуры алкилзамещенных 3-циано-2-пиридонов» (требуется подписка) . Zeitschrift für Naturforschung . 59 (59b): 1121–1131. DOI : 10.1515 / ZNB-2004-1008 . S2CID 98273691 .
- ↑ Ensign, Jerald C .; Риттенберг, Сидней К. (1963). «Кристаллический пигмент, полученный из 2-гидроксипиридина с помощью Arthrobacter crystallopoietes n.sp». Archiv für Mikrobiologie . 47 (2): 137–153. DOI : 10.1007 / BF00422519 . PMID 14106078 . S2CID 6389661 .
- ^ а б Sims, ВГ; О'Лафлин, EJ; Кроуфорд, Рональд (1989). «Разложение пиридинов в окружающей среде» (PDF) . CRC Critical Reviews в области экологического контроля . 19 (4): 309–340. DOI : 10.1080 / 10643388909388372 . Архивировано из оригинального (PDF) 27 мая 2010 года.
- ^ Oloughlin, E; Kehrmeyer, S; Симс, Г. (1996). «Выделение, характеристика и использование субстрата бактерии, разлагающей хинолин». Международный биоразложение и биоразложение . 38 (2): 107–118. DOI : 10.1016 / S0964-8305 (96) 00032-7 .
- ^ Sims, Джеральд К .; О (1992). «Продукция рибофлавина при росте Micrococcus luteus на пиридине» . Прикладная и экологическая микробиология . 58 (10): 3423–3425. DOI : 10,1128 / AEM.58.10.3423-3425.1992 . PMC 183117 . PMID 16348793 .
Общие ссылки [ править ]
- Engdahl K .; Альберг П. (1977). Журнал химических исследований : 340–341. Отсутствует или пусто
|title=( справка ) - Bensaude O, Chevrier M, Dubois J (1978). "Лактим-лактамное таутомерное равновесие 2-гидроксипиридинов. 1. Связывание катионов, димеризация и механизм взаимного превращения в апротонных растворителях. Спектроскопическое исследование и кинетическое исследование скачка температуры". Варенье. Chem. Soc. 100 (22): 7055–7066. DOI : 10.1021 / ja00490a046 .
- Бенсауд О, Дрейфус Дж, Додин Дж, Дюбуа Дж (1977). "Внутримолекулярный недиссоциативный перенос протона в водных растворах таутомерных гетероциклов: исследование кинетики скачка температуры". Варенье. Chem. Soc. 99 (13): 4438–4446. DOI : 10.1021 / ja00455a037 .
- Bensaude O, Chevrier M, Dubois J (1978). «Влияние гидратации на таутомерное равновесие». Tetrahedron Lett. 19 (25): 2221–2224. DOI : 10.1016 / S0040-4039 (01) 86850-7 .
- Хаммес Г.Г., Парк AC (1969). «Кинетические и термодинамические исследования водородной связи». Варенье. Chem. Soc. 91 (4): 956–961. DOI : 10.1021 / ja01032a028 .
- Хаммес Г.Г., Спайви Х.О. (1966). "Кинетическое исследование димеризации водородной связи 2-пиридона". Варенье. Chem. Soc. 88 (8): 1621–1625. DOI : 10.1021 / ja00960a006 . PMID 5942979 .
- Клюв П., Ковингтон Дж. Б., Смит С. Г. (1976). «Структурные исследования таутомерных систем: важность ассоциации 2-гидроксипиридин-2-пиридона и 2-меркаптопиридин-2-тиопиридона». Варенье. Chem. Soc. 98 (25): 8284–8286. DOI : 10.1021 / ja00441a079 .
- Клюв П., Ковингтон Дж. Б., Уайт Дж. М. (1980). «Количественная модель воздействия растворителя на равновесие гидроксипиридин-пиридон и меркаптопиридин-тиопиридон: корреляция с полем реакции и эффектами водородной связи». J. Org. Chem. 45 (8): 1347–1353. DOI : 10.1021 / jo01296a001 .
- Клюв П., Ковингтон Дж. Б., Смит С. Г., Уайт Дж. М., Зейглер Дж. М. (1980). «Смещение протомерных равновесий путем самоассоциации: пары изомеров гидроксипиридин-пиридон и меркаптопиридин-тиопиридон». J. Org. Chem. 45 (8): 1354–1362. DOI : 10.1021 / jo01296a002 .