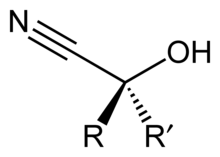
Циангидрин является функциональной группой , содержится в органических соединениях , в которых циано~d и гидроксигруппы присоединены к одному атому углерода. Общая формула - R 2 C (OH) CN, где R представляет собой H, алкил или арил . Цианогидрины являются промышленно важными предшественниками карбоновых кислот и некоторых аминокислот . Циангидринов могут быть образованы с помощью реакции циангидрина , который включает в себя обработку кетона или альдегида с цианистого водорода (HCN) в присутствии избыточных количеств цианида натрия (NaCN) в качестве катализатора:[1]
- RR'C = O + HCN → RR'C (OH) CN
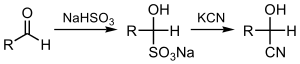
В этой реакции нуклеофильный ион CN - атакует электрофильный карбонильный углерод в кетоне с последующим протонированием HCN, тем самым регенерируя цианид-анион . Цианогидрины также получают замещением сульфита цианидными солями: [2]
Цианогидрины являются промежуточными продуктами синтеза аминокислот Стрекера . В водной кислоте они гидролизуются до α-гидроксикислоты .
Ацетонциангидрины [ править ]
Ацетонциангидрин , (CH 3 ) 2 C (OH) CN - циангидрин ацетона . Он образуется как промежуточный продукт при промышленном производстве метилметакрилата . [3] В лаборатории эта жидкость служит источником HCN, который неудобно летуч. [4] Таким образом, ацетонциангидрин может быть использован для получения других циангидринов, для превращения HCN к акцепторам Михаэля , так и для формилирования из аренов . Обработка этого циангидрина гидридом лития дает безводный цианид лития:
Препаративные методы [ править ]
Цианогидрины сначала были получены добавлением HCN и катализатора (основания или фермента) к соответствующему карбонилу. [5] В лабораторных условиях использование HCN (токсичного) в значительной степени не поощряется, по этой причине ищутся другие менее опасные реагенты для цианирования. Образование HCN in situ может происходить с использованием таких предшественников, как ацетонциангидрин. Альтернативно, цианосилильные производные, такие как TMS-CN, позволяют как цианирование, так и защиту за одну стадию без необходимости в HCN. [6] Сообщалось об аналогичных процедурах, основанных на образовании сложного эфира, фосфата и карбоната. [7] [8] [9]
Другие циангидрины [ править ]
Мандельонитрил , имеющий формулу C 6 H 5 CH (OH) CN, содержится в небольших количествах в косточках некоторых фруктов. [2] Известны родственные цианогенные гликозиды, такие как амигдалин . [1]
Гликолонитрил , также называемый гидроксиацетонитрилом или циангидрином формальдегида, представляет собой органическое соединение с формулой HOCH 2 CN. Это простейший циангидрин, производный от формальдегида . [10]
гликолонитрил
ацетонциангидрин
манделонитрил
См. Также [ править ]
- Галогидрин
Ссылки [ править ]
- ^ а б Дэвид Т. Моури (1948). «Приготовление нитрилов». Chem. Ред. 42 (2): 189–283. DOI : 10.1021 / cr60132a001 . PMID 18914000 .
- ^ а б Корсон, BB; Додж, РА; Harris, SA; Да, Дж. С. (1941). «Миндальная кислота» . Органический синтез .; Сборник , 1 , стр. 336
- ^ Уильям Бауэр младший «Метакриловая кислота и производные» в Энциклопедии промышленной химии Ульмана 2002, Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a16_441 . Дата публикации статьи в Интернете: 15 июня 2000 г.
- ^ Арутюнян, С.А. Энциклопедия реагентов для органического синтеза "ацетонциангидрин" 2001, John Wiley & Sons. DOI : 10.1002 / 047084289X.ra014
- ^ Север, М .; Усанов, ДЛ; Янг, К. Льюис, катализируемый кислотой асимметричный синтез циангидрина. Chem. Ред. 2008, 108 (12), 5146–5226. DOI: 10.1021 / cr800255k.
- ^ Lidy, W .; Sundermeyer, W. Spaltungsreaktionen Des Trimethylsilylcyanids, Eine Neue Darstellungsmethode Für O- (Trimethylsilyl) Cyanhydrine. Chem. Бер. 1973, 106 (2), 587–593. DOI: 10.1002 / cber.19731060224
- ^ Scholl, M .; Лим, СК; Fu, GC Удобное и эффективное преобразование альдегидов в ацилированные циангидрины с использованием цианида трибутилолова в качестве катализатора. J. Org. Chem. 1995, 60 (19), 6229–6231. DOI: 10.1021 / jo00124a052.
- ^ Йонеды, R .; Harusawa, S .; Курихара, Т. Цианофосфат: эффективное промежуточное соединение для хемоселективного превращения карбонильных соединений в нитрилы. J. Org. Chem. 1991, 56 (5), 1827–1832. DOI: 10.1021 / jo00005a031.
- ^ Juhl, M .; Петерсен, АР; Ли, Ж.-В. Синтез циангидрина с участием CO2 и простые итерационные реакции гомологации. Chem. - A Eur. J. 2020. DOI: 10.1002 / chem.202003623.
- ^ Годри, Р. (1955). «Гликолонитрил» . Органический синтез .; Сборник , 3 , с. 436
Внешние ссылки [ править ]
- Определение циангидринов в Золотой книге ИЮПАК [1]