Эта статья требует внимания специалиста в области медицины . ( Май 2018 г. ) |
| Сетчатка | |
|---|---|
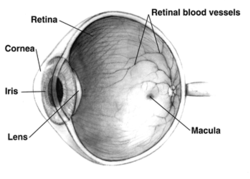 Поперечный разрез правого глаза человека ; глаза значительно различаются у животных. | |
| Подробности | |
| Произношение | Великобритания : / г ɛ т ɪ п ə / , США : / г ɛ т ən ə / , пл. сетчатка / - п я / |
| Часть | Глаз |
| Система | Визуальная система |
| Артерия | Центральная артерия сетчатки |
| Идентификаторы | |
| латинский | Сеть |
| MeSH | D012160 |
| TA98 | A15.2.04.002 |
| TA2 | 6776 |
| FMA | 58301 |
| Анатомическая терминология | |
Сетчатки глаза (от латинского : рете ) является внутренний, светочувствительный слой ткани глаза большинства позвоночных и некоторых моллюсков . Оптика глаза создает сфокусированное двумерное изображение визуального мира на сетчатке, которое преобразует это изображение в электрические нейронные импульсы в мозг для создания визуального восприятия . Сетчатка выполняет функцию, аналогичную функции пленки или датчика изображения в фотоаппарате .
Нервная сетчатка состоит из нескольких слоев нейронов, связанных между собой синапсами, и поддерживается внешним слоем пигментированных эпителиальных клеток. Первичные светочувствительные клетки сетчатки - это фоторецепторные клетки , которые бывают двух типов: палочки и колбочки . Жезлы работают в основном при тусклом свете и обеспечивают черно-белое изображение. Колбочки функционируют в хорошо освещенных условиях и отвечают за восприятие цвета, а также за высокую остроту зрения, используемую для таких задач, как чтение. Третий тип светочувствительных клеток, светочувствительные ганглиозные клетки , важен для захвата циркадных ритмов и рефлексивных реакций, таких какзрачковый световой рефлекс .
Свет, падающий на сетчатку, инициирует каскад химических и электрических событий, которые в конечном итоге запускают нервные импульсы, которые отправляются в различные зрительные центры мозга через волокна зрительного нерва . Нейронные сигналы от палочек и колбочек обрабатываются другими нейронами, выход которых принимает форму потенциалов действия в ганглиозных клетках сетчатки , аксоны которых образуют зрительный нерв. [1] Некоторые важные особенности зрительного восприятия можно проследить до кодирования сетчатки глаза и обработки света.
При эмбриональном развитии позвоночных сетчатка и зрительный нерв возникают как выросты развивающегося мозга, особенно эмбрионального промежуточного мозга ; таким образом, сетчатка считается частью центральной нервной системы (ЦНС) и фактически является тканью мозга. [2] [3] Это единственная часть ЦНС, которую можно визуализировать неинвазивно .
Структура [ править ]
Инвертированная сетчатка по сравнению с не инвертированной [ править ]
Сетчатка позвоночных перевернута в том смысле, что светочувствительные клетки находятся позади сетчатки, так что свет должен проходить через слои нейронов и капилляров, прежде чем достигнет палочек и колбочек. [4] Ганглиозные клетки, аксоны которых образуют зрительный нерв, находятся в передней части сетчатки; поэтому зрительный нерв должен проходить через сетчатку на пути к мозгу. В этой области нет фоторецепторов, что приводит к появлению слепого пятна . [5] Напротив, в сетчатке головоногих фоторецепторы находятся спереди, а обрабатывающие нейроны и капилляры - позади них. Благодаря этому у головоногих моллюсков нет слепого пятна.
Хотя вышележащая нервная ткань частично прозрачна, а сопутствующие глиальные клетки, как было показано, действуют как оптоволоконные каналы для передачи фотонов непосредственно к фоторецепторам, [6] [7] светорассеяние действительно происходит. [8] У некоторых позвоночных, включая человека, есть область центральной сетчатки, адаптированная для высокой остроты зрения. Эта область, называемая центральной ямкой , является бессосудистой (не имеет кровеносных сосудов) и имеет минимальную нервную ткань перед фоторецепторами, что сводит к минимуму рассеяние света. [8]
У головоногих моллюсков не перевернутая сетчатка, по разрешающей способности сопоставимая с глазами многих позвоночных. Глаза кальмаров не имеют аналога пигментного эпителия сетчатки позвоночных (РПЭ). Хотя их фоторецепторы содержат белок, ретинохром, который рециркулирует сетчатку и воспроизводит одну из функций РПЭ позвоночных, можно утверждать, что фоторецепторы головоногих моллюсков не поддерживаются так же хорошо, как у позвоночных, и что, в результате, полезный срок службы фоторецепторов в организме беспозвоночные намного короче позвоночных. [9] Легкая замена стебельчатых глаз (у некоторых лобстеров) или сетчатки (у некоторых пауков, таких как Дейнопис [10] ) встречается редко.
Сетчатка головоногих не возникает как продукт мозга, как у позвоночных. Можно утверждать, что это различие показывает, что глаза позвоночных и головоногих не гомологичны, а развивались отдельно. С эволюционной точки зрения более сложная структура, такая как перевернутая сетчатка, обычно может возникать как следствие двух альтернативных процессов: (а) выгодный «хороший» компромисс между конкурирующими функциональными ограничениями или (б) как исторически неадаптивный пережиток запутанный путь эволюции и трансформации органов. Зрение - важная адаптация у высших позвоночных.
Третий взгляд на «перевернутый» глаз позвоночных состоит в том, что он сочетает в себе два преимущества: поддержание фоторецепторов, упомянутых выше, и снижение интенсивности света, необходимое для предотвращения ослепления фоторецепторов, которые основаны на чрезвычайно чувствительных глазах предков современные миксы (рыба, обитающая в очень глубокой темной воде). [11]
Слои сетчатки [ править ]
Сетчатка позвоночных состоит из десяти отдельных слоев. [13] От самого близкого до самого дальнего от стекловидного тела:
- Внутренняя ограничивающая мембрана - базальная мембрана, разработанная клетками Мюллера .
- Слой нервных волокон - аксоны тел ганглиозных клеток (обратите внимание, что между этим слоем и внутренней ограничивающей мембраной существует тонкий слой ножек клеток Мюллера).
- Слой ганглиозных клеток - содержит ядра ганглиозных клеток, аксоны которых становятся волокнами зрительного нерва, и некоторые смещенные амакриновые клетки . [2]
- Внутренний плексиформный слой - содержит синапс между аксонами биполярных клеток и дендритами ганглиозных и амакриновых клеток. [2]
- Внутренний ядерный слой - содержит ядра и окружающие клеточные тела (перикарионы) амакриновых клеток , биполярных клеток и горизонтальных клеток . [2]
- Наружный плексиформный слой - выступы палочек и колбочек, заканчивающиеся сферулой палочек и ножкой конуса соответственно. Они образуют синапсы с дендритами биполярных клеток и горизонтальных клеток. [2] В макулярной области это известно как волокнистый слой Генле .
- Наружный ядерный слой - клеточные тела палочек и колбочек.
- Внешняя ограничивающая мембрана - слой, который отделяет внутренние сегменты фоторецепторов от их ядер клеток.
- Слой внутреннего сегмента / внешнего сегмента - внутренние сегменты и внешние сегменты стержней и колбочек. Наружные сегменты содержат узкоспециализированный светочувствительный аппарат. [14] [15]
- Пигментный эпителий сетчатки - однослойный кубовидный эпителиальный слой (с выступами, не показанными на схеме). Этот слой находится ближе всего к сосудистой оболочке глаза и обеспечивает питание и поддерживающие функции нервной системы сетчатки. Черный пигмент меланин в пигментном слое предотвращает отражение света по всему земному шару глазного яблока; это чрезвычайно важно для ясного зрения. [16] [17] [18]
Эти слои можно сгруппировать в 4 основных этапа обработки: фоторецепция; передача биполярным клеткам ; передача ганглиозным клеткам , которые также содержат фоторецепторы, светочувствительным ганглиозным клеткам ; и передача по зрительному нерву. На каждой синаптической стадии есть также латерально соединяющиеся горизонтальные и амакриновые клетки .
Зрительный нерв является одним из центральных путей многих аксонов ганглиозных клеток , соединяющих прежде всего к боковому коленчатому тела , визуальная ретрансляционной станции в диэнцефалона ( в заднюю части переднего мозга). Он также проецируется на верхний бугорок , супрахиазматическое ядро и ядро зрительного тракта . Он проходит через другие слои, образуя диск зрительного нерва у приматов. [19]
Дополнительные структуры, не связанные напрямую со зрением, обнаруживаются в виде выростов сетчатки у некоторых групп позвоночных. В птицах , то гребень является сосудистой структурой сложной формы , что выступает из сетчатки в стекловидное тело ; он снабжает глаза кислородом и питательными веществами, а также может улучшить зрение. Рептилии имеют похожее, но гораздо более простое строение. [20]
У взрослых людей вся сетчатка составляет примерно 72% сферы диаметром около 22 мм. Вся сетчатка содержит около 7 миллионов колбочек и от 75 до 150 миллионов палочек. Диск зрительного нерва, часть сетчатки, которую иногда называют «слепым пятном», потому что в нем отсутствуют фоторецепторы, расположен в зрительном сосочке , где волокна зрительного нерва выходят из глаза. Он выглядит как овальная белая область площадью 3 мм². Височная (в направлении висков) к этому диску находится макула , в центре которой находится ямка , ямка , которая отвечает за наше резкое центральное зрение, но на самом деле менее чувствительна к свету из-за отсутствия стержней. Человеческие и нечеловеческие приматыобладают одной ямкой, в отличие от некоторых видов птиц, таких как двулистные ястребы, а также собак и кошек, у которых нет ямки, но есть центральная полоса, известная как зрительная полоса. [ цитата необходима ] Вокруг ямки простирается центральная сетчатка примерно на 6 мм, а затем и периферическая сетчатка. Самый дальний край сетчатки определяется зубчатой линией . Расстояние от одного или другого до другого (или макулы), наиболее чувствительной области вдоль горизонтального меридиана, составляет около 32 мм. [ требуется разъяснение ]
На срезе сетчатка не более 0,5 мм толщиной. Он состоит из трех слоев нервных клеток и двух синапсов , включая уникальный ленточный синапс . Зрительный нерв переносит аксоны ганглиозных клеток в мозг и кровеносные сосуды, снабжающие сетчатку. Ганглиозные клетки лежат внутри глаза, а светочувствительные клетки - за его пределами. Из-за этого нелогичного устройства свет должен сначала пройти через ганглиозные клетки и сквозь толщу сетчатки (включая ее капиллярные сосуды, не показанные на рисунке), прежде чем достигнет палочек и колбочек. Свет поглощается пигментным эпителием сетчатки или сосудистой оболочкой (оба непрозрачны).
В лейкоциты в капиллярах перед фоторецепторов может восприниматься как небольшие яркие движущихся точек при взгляде на синий свет. Это известно как энтоптический феномен синего поля (или феномен Шерера ).
Между слоем ганглиозных клеток и палочками и колбочками находятся два слоя нейропилей, в которых осуществляются синаптические контакты. Слои нейропиля - это внешний плексиформный слой и внутренний плексиформный слой . Во внешнем слое нейропиля палочки и колбочки соединяются с вертикально движущимися биполярными клетками , а горизонтально ориентированные горизонтальные клетки соединяются с ганглиозными клетками.
Центральная сетчатка преимущественно содержит колбочки, а периферическая сетчатка - преимущественно палочки. Всего насчитывается около семи миллионов колбочек и сто миллионов стержней. В центре макулы находится фовеальная ямка, в которой колбочки узкие и длинные, и, расположенные в виде шестиугольной мозаики , наиболее плотные, в отличие от гораздо более толстых колбочек, расположенных более периферически в сетчатке. [21] В фовеальной ямке другие слои сетчатки смещаются, прежде чем нарастать вдоль наклона фовеа до края ямки, или парафовеа., достигается самая толстая часть сетчатки. Макула имеет желтую пигментацию из-за скрининговых пигментов и известна как желтое пятно. Область, непосредственно окружающая ямку, имеет наибольшую плотность палочек, сходящихся на единичных биполярных клетках. Поскольку ее конусы имеют гораздо меньшую сходимость сигналов, ямка обеспечивает самое резкое зрение, которое только может получить глаз. [2]
Хотя палочка и колбочки представляют собой своего рода мозаику , передача от рецепторов к биполярам и ганглиозным клеткам не является прямой. Поскольку существует около 150 миллионов рецепторов и только 1 миллион волокон зрительного нерва, должна происходить конвергенция и, следовательно, смешение сигналов. Более того, горизонтальное действие горизонтальных и амакриновых клеток может позволить одной области сетчатки контролировать другую (например, один стимул подавляет другой). Это торможение является ключом к уменьшению количества сообщений, отправляемых в высшие области мозга. У некоторых низших позвоночных (например, голубь) существует «центробежный» контроль сообщений - то есть один слой может контролировать другой, или более высокие области мозга могут управлять нервными клетками сетчатки, но у приматов этого не происходит. [2]
Слои, которые можно представить с помощью оптической когерентной томографии [ править ]
С помощью оптической когерентной томографии (ОКТ) в сетчатке можно идентифицировать 18 слоев. Слои и анатомическая корреляция следующие: [22] [23] [24]
От самого внутреннего до самого внешнего, уровни, идентифицируемые OCT, следующие:
| # | Слой OCT / Обычная этикетка | Анатомический коррелят | Отражательная способность в октябре | Конкретный анатомический границы? | Дополнительный Рекомендации |
|---|---|---|---|---|---|
| 1 | Задний кортикальный слой стекловидного тела | Задний кортикальный слой стекловидного тела | Гиперотражающий | да | [23] |
| 2 | Преретинальное пространство | В глазах, где стекловидное тело полностью или частично отделилось от сетчатки, это пространство, образованное между задней частью кортикального слоя стекловидного тела и внутренней ограничивающей мембраной сетчатки. | Гипоотражающий | [23] | |
| 3 | Внутренняя ограничивающая мембрана (ILM) | Сформированные клетки Мюллера endfeet (неясно, можно ли это наблюдать на ОКТ) | Гиперотражающий | Нет | [23] |
| Слой нервных волокон (NFL) | Аксоны ганглиозных клеток движутся к зрительному нерву | ||||
| 4 | Слой ганглиозных клеток (GCL) | Тела ганглиозных клеток (и некоторые смещенные амакриновые клетки ) | Гипоотражающий | [23] | |
| 5 | Внутренний плексиформный слой (IPL) | Синапсы между биполярными , амакриновыми и ганглиозными клетками | Гиперотражающий | [23] | |
| 6 | Внутренний ядерный слой (INL) | а) Горизонтальные , биполярные и амакриновые клеточные тела б) Ядра клеток Мюллера | Гипоотражающий | [23] | |
| 7 | Внешний плексиформный слой (OPL) | Синапсы между фоторецепторами , биполярными и горизонтальными клетками | Гиперотражающий | [23] | |
| 8 | (Внутренняя половина) слой нервных волокон Генле (HL) | Фоторецепторные аксоны (косо ориентированные волокна; отсутствуют в средней или периферической сетчатке) | Гипоотражающий | Нет | [23] |
| (Внешняя половина) Внешний ядерный слой (ONL) | В фоторецепторах клеточных тел | ||||
| 9 | Внешняя ограничивающая мембрана (ELM) | Состоит из прикрепленных зонул между клетками Мюллера и внутренними сегментами фоторецепторов. | Гиперотражающий | [23] | |
| 10 | Миоидная зона (МЗ) | Самая внутренняя часть внутреннего сегмента фоторецептора (IS), содержащая:
| Гипоотражающий | Нет | [25] [26] |
| 11 | Зона эллипсоида (EZ) | Самая удаленная часть внутреннего сегмента фоторецептора (IS) упакована митохондриями. | Очень гиперотражающий | Нет | [22] [27] [25] [23] [28] [29] |
| Соединение IS / OS или линия целостности фоторецепторов (PIL) | Фоторецептор, соединяющий реснички, соединяющие внутренний и внешний сегменты фоторецепторных клеток. | ||||
| 12 | Наружные сегменты фоторецепторов (OS) | На наружных сегментов фоторецепторов (ОС) , которые содержат диски , заполненные опсина , молекула , которая поглощает фотоны. | Гипоотражающий | [30] [23] | |
| 13 | Зона пересечения (IZ) | Вершины клеток РПЭ, покрывающие часть ОС колбочек. Слабо отличим от РПЭ. Ранее: «Линия вершин внешнего сегмента конуса» (СТОИМОСТЬ) | Гиперотражающий | Нет | |
| 14 | Комплекс РПЭ / Бруха | Фагосомная зона РПЭ | Очень гиперотражающий | Нет | [22] [23] |
| Зона меланосом РПЭ | Гипоотражающий | ||||
| Зона митохондрий RPE + соединение между RPE и мембраной Бруха | Очень гиперотражающий | ||||
| 15 | Хориокапилляры | Тонкий слой умеренной отражательной способности во внутренней сосудистой оболочке | Нет | [23] | |
| 16 | Слой Саттлера | Толстый слой гиперотражающих профилей круглой или овальной формы с гипорефлективными сердцевинами в средней части сосудистой оболочки. | [23] | ||
| 17 | Слой Галлера | Толстый слой овальных гиперотражающих профилей с гипорефлективными сердцевинами в наружной сосудистой оболочке | [23] | ||
| 18 | Хориоидально-склеральный переход | Зона внешней хориоидеи с заметным изменением текстуры, в которой большие круглые или яйцевидные профили примыкают к однородная область переменной отражательной способности | [23] | ||
Развитие [ править ]
Развитие сетчатки начинается с образования глазных полей, опосредованных белками SHH и SIX3 , с последующим развитием зрительных пузырьков, регулируемых белками PAX6 и LHX2 . [31] Роль Pax6 в развитии глаз была элегантно продемонстрирована Walter Gehring с коллегами, которые показали, что эктопическая экспрессия Pax6 может приводить к образованию глаз на антеннах, крыльях и ногах дрозофилы . [32]Оптический пузырек дает начало трем структурам: нервной сетчатке, пигментированному эпителию сетчатки и оптическому стеблю. Нервная сетчатка содержит клетки-предшественники сетчатки (RPC), которые дают начало семи типам клеток сетчатки. Дифференциация начинается с ганглиозных клеток сетчатки и завершается образованием глии Мюллера. [33] Хотя каждый тип клеток отличается от RPC в последовательном порядке, существует значительное перекрытие во времени, когда дифференцируются отдельные типы клеток. [31] Сигналы, которые определяют судьбу дочерних клеток RPC, кодируются множеством семейств факторов транскрипции, включая факторы bHLH и гомеодомена . [34] [35]
Помимо определения судьбы направляющих клеток, в сетчатке существуют сигналы для определения дорсально-вентральной (DV) и назально-височной (NT) осей. Ось DV устанавливается с помощью вентрального к дорсальному градиенту VAX2 , тогда как ось NT координируется экспрессией факторов транскрипции вилки FOXD1 и FOXG1 . Внутри сетчатки образуются дополнительные градиенты. [35] Это пространственное распределение может способствовать правильному нацеливанию аксонов RGC, которые функционируют, чтобы установить ретинотопную карту. [31]
Кровоснабжение [ править ]
Эта статья поднимает множество проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалить эти сообщения-шаблоны ) ( Узнайте, как и когда удалить этот шаблон сообщения )
|
Сетчатка разделена на отдельные слои, каждый из которых содержит определенные типы клеток или клеточные компартменты [36] , метаболизм которых имеет различные потребности в питании. [37] Чтобы удовлетворить эти требования, глазная артерия разветвляется и снабжает сетчатку двумя различными сосудистыми сетями: хориоидальной сетью, которая снабжает сосудистую оболочку и внешнюю сетчатку, и сетчаткой сетчаткой, которая снабжает внутренний слой сетчатки. [38]
Механизмы кровообращения [ править ]
На первый взгляд, можно подумать, что сетчатка позвоночного «неправильно спроектирована» или «плохо спроектирована»; но на самом деле сетчатка не могла бы функционировать, если бы ее не перевернули. Слой фоторецепторов должен быть встроен в пигментный эпителий сетчатки (РПЭ), который выполняет как минимум семь жизненно важных функций [39]. one of the most obvious being to supply oxygen and other necessary nutrients needed for the photoreceptors to function. These nutrients include glucose, fatty acids, and retinal. The mammalian photoreceptor amplification process uses large quantities energy for vision in photopic conditions (requiring less under scotopic conditions) and, thus, requires the large supply nutrients supplied by the blood vessels in the choroid, which lies beyond the RPE. The choroid supplies about 75% of these nutrients to the retina and the retinal vasculature only 25%.[4]
When light strikes 11-cis-retinal (in the disks in the rods and cones), 11-cis-retinal changes to all-trans-retinal which then triggers changes in the opsins. Now, the outer segments do not regenerate the retinal back into the cis- form once it has been changed by light. Instead the retinal is pumped out to the surrounding RPE where it is regenerated and transported back into the outer segments of the photoreceptors. This recycling function of the RPE protects the photoreceptors against photo-oxidative damage[40][41] and allows the photoreceptor cells to have decades-long useful lives.
In birds[edit]
The bird retina is devoid of blood vessels, perhaps to give unobscured passage of light for forming images, thus giving better resolution. It is, therefore, a considered view that the bird retina depends for nutrition and oxygen supply on a specialized organ, called the "pecten" or pecten oculi, located on the blind spot or optic disk. This organ is extremely rich in blood vessels and is thought to supply nutrition and oxygen to the bird retina by diffusion through the vitreous body. The pecten is highly rich in alkaline phosphatase activity and polarized cells in its bridge portion – both befitting its secretory role.[42]Клетки пектена заполнены темными гранулами меланина, которые, как предполагалось, сохраняют этот орган в тепле за счет поглощения паразитного света, падающего на пектен. Считается, что это увеличивает скорость метаболизма пектена, тем самым экспортируя больше питательных молекул для удовлетворения строгих энергетических потребностей сетчатки в течение длительных периодов воздействия света. [43]
Биометрическая идентификация и диагностика болезни [ править ]
The bifurcations and other physical characteristics of the inner retinal vascular network are known to vary among individuals,[44] and these individual variances have been used for biometric identification and for early detection of the onset of disease. The mapping of vascular bifurcations is one of the basic steps in biometric identification.[45] Results of such analyses of retinal blood vessel structure can be evaluated against the ground truth data[46] of vascular bifurcations of retinal fundus images that are obtained from the DRIVE dataset.[47] In addition, the classes of vessels of the DRIVE dataset have also been identified,[48] and an automated method for accurate extraction of these bifurcations is also available.[49] Changes in retinal blood circulation are seen with aging[50] and exposure to air pollution,[51] and may indicate cardiovascular diseases such as hypertension and atherosclerosis.[52][53][54] Determining the equivalent width of arterioles and venules near the optic disc is also a widely used technique to identify cardiovascular risks.[55]
Function[edit]
Сетчатка преобразует оптическое изображение в нервные импульсы, начиная с шаблонного возбуждения цветочувствительных пигментов своих палочек и колбочек, фоторецепторных клеток сетчатки . Возбуждение обрабатывается нейронной системой и различными частями мозга, работающими параллельно, чтобы сформировать представление о внешней среде в мозгу.
The cones respond to bright light and mediate high-resolution colour vision during daylight illumination (also called photopic vision). The rod responses are saturated at daylight levels and don't contribute to pattern vision. However, rods do respond to dim light and mediate lower-resolution, monochromatic vision under very low levels of illumination (called scotopic vision). The illumination in most office settings falls between these two levels and is called mesopic vision. At mesopic light levels, both the rods and cones are actively contributing pattern information. What contribution the rod information makes to pattern vision under these circumstances is unclear.
The response of cones to various wavelengths of light is called their spectral sensitivity. In normal human vision, the spectral sensitivity of a cone falls into one of three subtypes, often called blue, green, and red, but more accurately known as short, medium, and long wavelength-sensitive cone subtypes. It is a lack of one or more of the cone subtypes that causes individuals to have deficiencies in colour vision or various kinds of colour blindness. These individuals are not blind to objects of a particular colour, but are unable to distinguish between colours that can be distinguished by people with normal vision. Humans have this trichromatic vision, в то время как у большинства других млекопитающих нет колбочек с чувствительным к красному пигментом, и поэтому у них плохое двухцветное цветовое зрение. Однако у некоторых животных есть четыре спектральных подтипа, например, форель добавляет ультрафиолетовую подгруппу к коротким, средним и длинным подтипам, которые похожи на людей. Некоторые рыбы также чувствительны к поляризации света.
In the photoreceptors, exposure to light hyperpolarizes the membrane in a series of graded shifts. The outer cell segment contains a photopigment. Inside the cell the normal levels of cyclic guanosine monophosphate (cGMP) keep the Na+ channel open, and thus in the resting state the cell is depolarised. The photon causes the retinal bound to the receptor protein to isomerise to trans-retinal. This causes the receptor to activate multiple G-proteins. This in turn causes the Ga-subunit of the protein to activate a phosphodiesterase (PDE6), which degrades cGMP, resulting in the closing of Na+ cyclic nucleotide-gated ion channels (CNGs). Thus the cell is hyperpolarised. The amount of neurotransmitter released is reduced in bright light and increases as light levels fall. The actual photopigment is bleached away in bright light and only replaced as a chemical process, so in a transition from bright light to darkness the eye can take up to thirty minutes to reach full sensitivity.
When thus excited by light, the photoceptor sends a proportional response synaptically to bipolar cells which in turn signal the retinal ganglion cells. The photoreceptors are also cross-linked by horizontal cells and amacrine cells, which modify the synaptic signal before it reaches the ganglion cells, the neural signals being intermixed and combined. Of the retina's nerve cells, only the retinal ganglion cells and few amacrine cells create action potentials.
In the retinal ganglion cells there are two types of response, depending on the receptive field of the cell. The receptive fields of retinal ganglion cells comprise a central, approximately circular area, where light has one effect on the firing of the cell, and an annular surround, where light has the opposite effect. In ON cells, an increment in light intensity in the centre of the receptive field causes the firing rate to increase. In OFF cells, it makes it decrease. In a linear model, this response profile is well described by a difference of Gaussians and is the basis for edge detectionалгоритмы. Помимо этого простого различия, ганглиозные клетки также различаются по хроматической чувствительности и типу пространственного суммирования. Клетки, демонстрирующие линейное пространственное суммирование, называются X-клетками (также называемыми парвоцеллюлярными, P или сверхмалыми ганглиозными клетками), а те, которые демонстрируют нелинейное суммирование, являются Y-клетками (также называемыми магноклеточными, M или паразольными ганглиозными клетками сетчатки), хотя соответствие между X- и Y-клетки (в сетчатке кошки) и P- и M-клетки (в сетчатке приматов) не так просты, как когда-то казалось.
In the transfer of visual signals to the brain, the visual pathway, the retina is vertically divided in two, a temporal (nearer to the temple) half and a nasal (nearer to the nose) half. The axons from the nasal half cross the brain at the optic chiasma to join with axons from the temporal half of the other eye before passing into the lateral geniculate body.
Хотя существует более 130 миллионов рецепторов сетчатки, в зрительном нерве насчитывается только около 1,2 миллиона волокон (аксонов). Таким образом, большая часть предварительной обработки выполняется внутри сетчатки. Ямка производит наиболее точную информацию. Несмотря на то, что они занимают около 0,01% поля зрения (менее 2 ° угла зрения ), около 10% аксонов зрительного нерва посвящены ямке. Предел разрешения фовеа составляет около 10 000 точек. Информационная емкость оценивается в 500 000 бит в секунду (для получения дополнительной информации о битах см. Теорию информации ) без цвета или около 600 000 бит в секунду, включая цвет. [56]
Пространственное кодирование [ править ]
When the retina sends neural impulses representing an image to the brain, it spatially encodes (compresses) those impulses to fit the limited capacity of the optic nerve. Compression is necessary because there are 100 times more photoreceptor cells than ganglion cells. This is done by "decorrelation", which is carried out by the "centre–surround structures", which are implemented by the bipolar and ganglion cells.
В сетчатке есть два типа центрально-окружающих структур - на центрах и вне центра. На центрах есть положительно взвешенный центр и отрицательно взвешенный объемный звук. Вне центров как раз наоборот. Положительное взвешивание более известно как возбуждающее , а отрицательное - как тормозящее .
These centre–surround structures are not physical apparent, in the sense that one cannot see them by staining samples of tissue and examining the retina's anatomy. The centre–surround structures are logical (i.e., mathematically abstract) in the sense that they depend on the connection strengths between bipolar and ganglion cells. It is believed that the connection strength between cells is caused by the number and types of ion channels embedded in the synapses between the bipolar and ganglion cells.
The centre–surround structures are mathematically equivalent to the edge detection algorithms used by computer programmers to extract or enhance the edges in a digital photograph. Thus, the retina performs operations on the image-representing impulses to enhance the edges of objects within its visual field. For example, in a picture of a dog, a cat and a car, it is the edges of these objects that contain the most information. In order for higher functions in the brain (or in a computer for that matter) to extract and classify objects such as a dog and a cat, the retina is the first step to separating out the various objects within the scene.
As an example, the following matrix is at the heart of a computer algorithm that implements edge detection. This matrix is the computer equivalent to the centre–surround structure. In this example, each box (element) within this matrix would be connected to one photoreceptor. The photoreceptor in the centre is the current receptor being processed. The centre photoreceptor is multiplied by the +1 weight factor. The surrounding photoreceptors are the "nearest neighbors" to the centre and are multiplied by the −1/8 value. The sum of all nine of these elements is finally calculated. This summation is repeated for every photoreceptor in the image by shifting left to the end of a row and then down to the next line.
| -1/8 | -1/8 | -1/8 |
| -1/8 | +1 | -1/8 |
| -1/8 | -1/8 | -1/8 |
The total sum of this matrix is zero, if all the inputs from the nine photoreceptors are of the same value. The zero result indicates the image was uniform (non-changing) within this small patch. Negative or positive sums mean the image was varying (changing) within this small patch of nine photoreceptors.
The above matrix is only an approximation to what really happens inside the retina. The differences are:
- The above example is called "balanced". The term balanced means that the sum of the negative weights is equal to the sum of the positive weights so that they cancel out perfectly. Retinal ganglion cells are almost never perfectly balanced.
- The table is square while the centre–surround structures in the retina are circular.
- Neurons operate on spike trains traveling down nerve cell axons. Computers operate on a single floating point number that is essentially constant from each input pixel. (The computer pixel is basically the equivalent of a biological photoreceptor.)
- The retina performs all these calculations in parallel while the computer operates on each pixel one at a time. The retina performs no repeated summations and shifting as would a computer.
- Finally, the horizontal and amacrine cells play a significant role in this process, but that is not represented here.
Here is an example of an input image and how edge detection would modify it.
Once the image is spatially encoded by the centre–surround structures, the signal is sent out along the optic nerve (via the axons of the ganglion cells) through the optic chiasm to the LGN (lateral geniculate nucleus). The exact function of the LGN is unknown at this time. The output of the LGN is then sent to the back of the brain. Specifically, the output of the LGN "radiates" out to the V1 primary visual cortex.
Simplified signal flow: Photoreceptors → Bipolar → Ganglion → Chiasm → LGN → V1 cortex
Clinical significance[edit]
There are many inherited and acquired diseases or disorders that may affect the retina. Some of them include:
- Retinitis pigmentosa is a group of genetic diseases that affect the retina and cause the loss of night vision and peripheral vision.
- Macular degeneration describes a group of diseases characterized by loss of central vision because of death or impairment of the cells in the macula.
- Cone-rod dystrophy (CORD) describes a number of diseases where vision loss is caused by deterioration of the cones and/or rods in the retina.
- In retinal separation, the retina detaches from the back of the eyeball. Ignipuncture is an outdated treatment method. The term retinal detachment is used to describe a separation of the neurosensory retina from the retinal pigment epithelium.[57] There are several modern treatment methods for fixing a retinal detachment: pneumatic retinopexy, scleral buckle, cryotherapy, laser photocoagulation and pars plana vitrectomy.
- Both hypertension and diabetes mellitus can cause damage to the tiny blood vessels that supply the retina, leading to hypertensive retinopathy and diabetic retinopathy.
- Retinoblastoma is a cancer of the retina.
- Retinal diseases in dogs include retinal dysplasia, progressive retinal atrophy, and sudden acquired retinal degeneration.
- Lipemia retinalis is a white appearance of the retina, and can occur by lipid deposition in lipoprotein lipase deficiency.
- Retinal Detachment. The neural retina occasionally detaches from the pigment epithelium. In some instances, the cause of such detachment is injury to the eyeball that allows fluid or blood to collect between the neural retina and the pigment epithelium. Detachment is occasionally caused by contracture of fine collagenous fibrils in the vitreous humor, which pull areas of the retina toward the interior of the globe.[58]
- Night Blindness : Night blindness occurs in any person with severe vitamin A deficiency. The reason for this is that without vitamin A, the amounts of retinal and rhodopsin that can be formed are severely depressed. This condition is called night blindness because the amount of light available at night is too little to permit adequate vision in vitamin A–deficient persons.[59]
Diagnosis[edit]
A number of different instruments are available for the diagnosis of diseases and disorders affecting the retina. Ophthalmoscopy and fundus photography have long been used to examine the retina. Recently, adaptive optics has been used to image individual rods and cones in the living human retina, and a company based in Scotland has engineered technology that allows physicians to observe the complete retina without any discomfort to patients.[60]
The electroretinogram is used to non-invasively measure the retina's electrical activity, which is affected by certain diseases. A relatively new technology, now becoming widely available, is optical coherence tomography (OCT). This non-invasive technique allows one to obtain a 3D volumetric or high resolution cross-sectional tomogram of the fine structures of the retina, with histologic quality. Retinal vessel analysis is a non-invasive method to examine the small arteries and veins in the retina which allows to draw conclusions about the morphology and the function of small vessels elsewhere in the human body. It has been established as a predictor of cardiovascular disease[61] and seems to have, according to a study published in 2019, potential in the early detection of Alzheimer's disease.[62]
Treatment[edit]
Treatment depends upon the nature of the disease or disorder.
Common treatment modalities[edit]
The following are commonly modalities of management for retinal disease:
- Intravitreal medication, such as anti-VEGF or corticosteroid agents
- Vitreoretinal surgery
- Use of nutritional supplements
- Modification of systemic risk factors for retinal disease
Uncommon treatment modalities[edit]
Rare or uncommon methods of treatment for retinal disease |
|---|
Retinal gene therapy Gene therapy holds promise as a potential avenue to cure a wide range of retinal diseases. This involves using a non-infectious virus to shuttle a gene into a part of the retina. Recombinant adeno-associated virus (rAAV) vectors possess a number of features that render them ideally suited for retinal gene therapy, including a lack of pathogenicity, minimal immunogenicity, and the ability to transduce postmitotic cells in a stable and efficient manner.[63] rAAV vectors are increasingly utilized for their ability to mediate efficient transduction of retinal pigment epithelium (RPE), photoreceptor cells and retinal ganglion cells. Each cell type can be specifically targeted by choosing the appropriate combination of AAV serotype, promoter, and intraocular injection site. Several clinical trials have already reported positive results using rAAV to treat Leber's congenital amaurosis, showing that the therapy was both safe and effective.[64][65] There were no serious adverse events, and patients in all three studies showed improvement in their visual function as measured by a number of methods. The methods used varied among the three trials, but included both functional methods such as visual acuity[65][66][67] and functional mobility[66][67][68] as well as objective measures that are less susceptible to bias, such as the pupil's ability to respond to light[64][69] and improvements on functional MRI.[70] Improvements were sustained over the long-term, with patients continuing to do well after more than 1.5 years.[64][65] The unique architecture of the retina and its relatively immune-privileged environment help this process.[71] Tight junctions that form the blood retinal barrier separate the subretinal space from the blood supply, thus protecting it from microbes and most immune-mediated damage, and enhancing its potential to respond to vector-mediated therapies. The highly compartmentalized anatomy of the eye facilitates accurate delivery of therapeutic vector suspensions to specific tissues under direct visualization using microsurgical techniques.[72] In the sheltered environment of the retina, AAV vectors are able to maintain high levels of transgene expression in the retinal pigmented epithelium (RPE), photoreceptors, or ganglion cells for long periods of time after a single treatment. In addition, the eye and the visual system can be routinely and easily monitored for visual function and retinal structural changes after injections with noninvasive advanced technology, such as visual acuities, contrast sensitivity, fundus auto-fluorescence (FAF), dark-adapted visual thresholds, vascular diameters, pupillometry, electroretinography (ERG), multifocal ERG and optical coherence tomography (OCT).[73] This strategy is effective against a number of retinal diseases that have been studied, including neovascular diseases that are features of age-related macular degeneration, diabetic retinopathy and retinopathy of prematurity. Since the regulation of vascularization in the mature retina involves a balance between endogenous positive growth factors, such as vascular endothelial growth factor (VEGF) and inhibitors of angiogenesis, such as pigment epithelium-derived factor (PEDF), rAAV-mediated expression of PEDF, angiostatin, and the soluble VEGF receptor sFlt-1, which are all antiangiogenic proteins, have been shown to reduce aberrant vessel formation in animal models.[74] Since specific gene therapies cannot readily be used to treat a significant fraction of patients with retinal dystrophy, there is a major interest in developing a more generally applicable survival factor therapy. Neurotrophic factors have the ability to modulate neuronal growth during development to maintain existing cells and to allow recovery of injured neuronal populations in the eye. AAV encoding neurotrophic factors such as fibroblast growth factor (FGF) family members and GDNF either protected photoreceptors from apoptosis or slowed down cell death.[74] Organ transplantationTransplantation of retinas has been attempted, but without much success. At MIT, The University of Southern California, RWTH Aachen University, and the University of New South Wales, an "artificial retina" is under development: an implant which will bypass the photoreceptors of the retina and stimulate the attached nerve cells directly, with signals from a digital camera. |
History[edit]
In 1894, Santiago Ramón y Cajal published the first major characterization of retinal neurons in Retina der Wirbelthiere (The Retina of Vertebrates).[75]
George Wald, Haldan Keffer Hartline, and Ragnar Granit won the 1967 Nobel Prize in Physiology or Medicine for their scientific research on the retina.[76]
A recent University of Pennsylvania study calculated that the approximate bandwidth of human retinas is 8.75 megabits per second, whereas a guinea pig's retinal transfer rate is 875 kilobits per second.[77]
MacLaren & Pearson and colleagues at University College London and Moorfields Eye Hospital in London, in 2006, showed that photoreceptor cells could be transplanted successfully in the mouse retina if donor cells were at a critical developmental stage.[78] Recently Ader and colleagues in Dublin showed, using the electron microscope, that transplanted photoreceptors formed synaptic connections.[79]
In 2012, Sebastian Seung and his laboratory at MIT launched EyeWire, an online Citizen science game where players trace neurons in the retina.[80] The goals of the EyeWire project are to identify specific cell types within the known broad classes of retinal cells, and to map the connections between neurons in the retina, which will help to determine how vision works.[81][82]
Additional images[edit]
The structures of the eye labeled
Another view of the eye and the structures of the eye labeled
Illustration of image as 'seen' by the retina independent of optic nerve and striate cortex processing.
See also[edit]
- Adeno associated virus and gene therapy of the human retina
- Charles Schepens – "the father of modern retinal surgery"
- Evolution of the eye
- Duplex retina
- Retinal scan
- List of xanthoma variants associated with hyperlipoproteinemia subtypes
- Rhodopsin
References[edit]
- ^ J, Krause William (2005). Krause's Essential Human Histology for Medical Students. Boca Raton, FL: Universal Publishers. ISBN 978-1-58112-468-2.
- ^ a b c d e f g "Sensory Reception: Human Vision: Structure and function of the Human Eye" vol. 27, Encyclopædia Britannica, 1987
- ^ "Archived copy". Archived from the original on 11 March 2013. Retrieved 11 February 2013.CS1 maint: archived copy as title (link)
- ^ a b Kolb, Helga (1995). "Simple Anatomy of the Retina". Webvision. PMID 21413391. Retrieved 1 January 2018.
- ^ Kolb, Helga. "Photoreceptors". Webvision. Retrieved 11 January 2018.
- ^ Franze K, Grosche J, Skatchkov SN, Schinkinger S, Foja C, Schild D, Uckermann O, Travis K, Reichenbach A, Guck J (2007). "Muller cells are living optical fibers in the vertebrate retina". Proc. Natl. Acad. Sci. U.S.A. 104 (20): 8287–8292. Bibcode:2007PNAS..104.8287F. doi:10.1073/pnas.0611180104. PMC 1895942. PMID 17485670.
- ^ Baker, Oliver (23 April 2010). "Focus: Eye Cells as Light Pipes". Phys. Rev. Focus. 25 (15). doi:10.1103/physrevfocus.25.15.
- ^ a b Bringmann A, Syrbe S, Görner K, Kacza J, Francke M, Wiedemann P, Reichenbach A (2018). "The primate fovea: Structure, function and development". Prog Retin Eye Res. 66: 49–84. doi:10.1016/j.preteyeres.2018.03.006. PMID 29609042. S2CID 5045660.
- ^ Sperling, L.; Hubbard, R. (1 February 1975). "Squid retinochrome". The Journal of General Physiology. 65 (2): 235–251. doi:10.1085/jgp.65.2.235. ISSN 0022-1295. PMC 2214869. PMID 235007.
- ^ "How spiders see the world – Australian Museum". www.australian.museum. Archived from the original on 12 September 2017. Retrieved 5 December 2017.
- ^ Drazen, J. C.; Yeh, J.; Friedman, J.; Condon, N. (June 2011). "Metabolism and enzyme activities of hagfish from shallow and deep water of the Pacific Ocean". Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 159 (2): 182–187. doi:10.1016/j.cbpa.2011.02.018. PMID 21356325.
- ^ Foundations of Vision Archived 3 December 2013 at the Wayback Machine, Brian A. Wandell
- ^ The Retinal Tunic. Archived 18 May 2007 at the Wayback Machine Virginia–Maryland Regional College of Veterinary Medicine
- ^ Goldberg AF, Moritz OL, Williams DS (2016). "Molecular basis for photoreceptor outer segment architecture". Prog Retin Eye Res. 55: 52–81. doi:10.1016/j.preteyeres.2016.05.003. PMC 5112118. PMID 27260426.
- ^ Arshavsky VY, Burns ME (2012). "Photoreceptor signaling: supporting vision across a wide range of light intensities". J Biol Chem. 287 (3): 1620–1626. doi:10.1074/jbc.R111.305243. PMC 3265842. PMID 22074925.
- ^ Guyton and Hall Physiology. p. 612.
- ^ Sparrow JR, Hicks D, Hamel CP (2010). "The retinal pigment epithelium in health and disease". Curr Mol Med. 10 (9): 802–823. doi:10.2174/156652410793937813. PMC 4120883. PMID 21091424.
- ^ Letelier J, Bovolenta P, Martínez-Morales JR (2017). "The pigmented epithelium, a bright partner against photoreceptor degeneration". J Neurogenet. 31 (4): 203–215. doi:10.1080/01677063.2017.1395876. PMID 29113536. S2CID 1351539.
- ^ Shepherd, Gordon (2004). The Synaptic Organization of the Brain. New York: Oxford University Press. pp. 217–225. ISBN 978-0-19-515956-1.
- ^ Romer, Alfred Sherwood; Parsons, Thomas S. (1977). The Vertebrate Body. Philadelphia, PA: Holt-Saunders International. p. 465. ISBN 978-0-03-910284-5.
- ^ Guyton and Hall Physiology. p. 609.
- ^ a b c Cuenca, Nicolás; Ortuño-Lizarán, Isabel; Pinilla, Isabel (March 2018). "Cellular Characterization of OCT and Outer Retinal Bands Using Specific Immunohistochemistry Markers and Clinical Implications" (PDF). Ophthalmology. 125 (3): 407–422. doi:10.1016/j.ophtha.2017.09.016. hdl:10045/74474. PMID 29037595.
- ^ a b c d e f g h i j k l m n o p q Staurenghi, Giovanni; Sadda, Srinivas; Chakravarthy, Usha; Spaide, Richard F. (2014). "Proposed Lexicon for Anatomic Landmarks in Normal Posterior Segment Spectral-Domain Optical Coherence Tomography". Ophthalmology. 121 (8): 1572–1578. doi:10.1016/j.ophtha.2014.02.023. PMID 24755005.
- ^ Spectral domain optical coherence tomography in macular diseases. Meyer, Carsten H.; Saxena, Sandeep; Sadda, SriniVas R. New Delhi: Springer. 2017. ISBN 978-8132236108. OCLC 964379175.CS1 maint: others (link)
- ^ a b Hildebrand, Göran Darius; Fielder, Alistair R. (2011). Pediatric Retina. Springer, Berlin, Heidelberg. pp. 39–65. doi:10.1007/978-3-642-12041-1_2. ISBN 978-3642120404.
- ^ Turgut, Burak; University, Fırat; Medicine, School of; Ophthalmology, Department of; Elazig; Turkey (2017). "Past and Present Terminology for the Retinal and Choroidal Structures in Optical Coherence Tomography". European Ophthalmic Review. 11 (1): 59. doi:10.17925/eor.2017.11.01.59.
- ^ "Outer Retinal Layers as Predictors of Vision Loss". Review of Ophthalmology.
- ^ "The ABCs of OCT". Review of Optometry.
- ^ Sherman, J (June 2009). "Photoreceptor integrity line joins the nerve fiber layer as key to clinical diagnosis". Optometry. 80 (6): 277–278. doi:10.1016/j.optm.2008.12.006. PMID 19465337.
- ^ Boston, Marco A. Bonini Filho, MD, and Andre J. Witkin, MD. "Outer Retinal Layers as Predictors of Vision Loss". Retrieved 7 April 2018.
- ^ a b c Heavner, W; Pevny, L (1 December 2012). "Eye development and retinogenesis". Cold Spring Harbor Perspectives in Biology. 4 (12): a008391. doi:10.1101/cshperspect.a008391. PMC 3504437. PMID 23071378.
- ^ Halder, G; Callaerts, P; Gehring, WJ (24 March 1995). "Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila". Science. 267 (5205): 1788–1792. Bibcode:1995Sci...267.1788H. doi:10.1126/science.7892602. PMID 7892602.
- ^ Cepko, Connie (September 2014). "Intrinsically different retinal progenitor cells produce specific types of progeny". Nature Reviews Neuroscience. 15 (9): 615–627. doi:10.1038/nrn3767. ISSN 1471-003X. PMID 25096185. S2CID 15038502.
- ^ Hatakeyama, J; Kageyama, R (February 2004). "Retinal cell fate determination and bHLH factors". Seminars in Cell & Developmental Biology. 15 (1): 83–89. doi:10.1016/j.semcdb.2003.09.005. PMID 15036211.
- ^ a b Lo Giudice, Quentin; Leleu, Marion; La Manno, Gioele; Fabre, Pierre J. (1 September 2019). "Single-cell transcriptional logic of cell-fate specification and axon guidance in early-born retinal neurons". Development. 146 (17): dev178103. doi:10.1242/dev.178103. ISSN 0950-1991. PMID 31399471.
- ^ Remington, Lee Ann (2012). Clinical anatomy and physiology of the visual system (3rd ed.). St. Louis: Elsevier/Butterworth-Heinemann. ISBN 978-1-4377-1926-0. OCLC 745905738.
- ^ Yu, DY; Yu, PK; Cringle, SJ; Kang, MH; Su, EN (May 2014). "Functional and morphological characteristics of the retinal and choroidal vasculature". Progress in Retinal and Eye Research. 40: 53–93. doi:10.1016/j.preteyeres.2014.02.001. PMID 24583621. S2CID 21312546.
- ^ Kiel, Jeffrey W. Anatomy. Morgan & Claypool Life Sciences. Archived from the original on 5 December 2017. Retrieved 17 April 2017.
- ^ Strauss, Olaf. "The retinal pigment epithelium". Webvision. Retrieved 1 January 2018.
- ^ Photobiology of the retina "Light-Induced Damage to the Retina". Archived from the original on 9 August 2012. Retrieved 27 July 2012.
- ^ Diagrammatic representation of disc shedding and phagosome retrieval into the pigment epithelial cell "Archived copy". Archived from the original on 21 September 2012. Retrieved 27 July 2012.CS1 maint: archived copy as title (link)
- ^ Bawa S.R.; YashRoy R.C. (1972). "Effect of dark and light adaptation on the retina and pecten of chicken". Experimental Eye Research. 13 (1): 92–97. doi:10.1016/0014-4835(72)90129-7. PMID 5060117. Archived from the original on 9 October 2014.
- ^ Bawa, S.R.; YashRoy, R.C. (1974). "Structure and function of vulture pecten". Cells Tissues Organs. 89 (3): 473–480. doi:10.1159/000144308. PMID 4428954. Archived from the original on 14 July 2015.
- ^ Sherman, T (1981). "On connecting large vessels to small – the meaning of murray law". Journal of General Physiology. 78 (4): 431–453. doi:10.1085/jgp.78.4.431. PMC 2228620. PMID 7288393.
- ^ Azzopardi G.; Petkov N. (2011). Detection of retinal vascular bifurcations by trainable V4-like filters, in Computer Analysis of Images and Patterns (CAIP), Seville (PDF). Lecture Notes in Computer Science. 6854. pp. 451–459. doi:10.1007/978-3-642-23672-3_55. ISBN 978-3-642-23671-6. Archived (PDF) from the original on 9 August 2017.
- ^ "Retinal fundus images – Ground truth of vascular bifurcations and crossovers". University of Groningen. Retrieved 20 April 2018.
- ^ "DRIVE: Digital Retinal Images for Vessel Extraction". Image Sciences Institute, Utrecht University. Retrieved 20 April 2018.
- ^ Qureshi, T. A.; Habib, M.; Hunter, A.; Al-Diri, B. (June 2013). A manually-labeled, artery/vein classified benchmark for the DRIVE dataset. Proceedings of the 26th IEEE International Symposium on Computer-Based Medical Systems. pp. 485–488. doi:10.1109/cbms.2013.6627847. ISBN 978-1-4799-1053-3. S2CID 7705121.
- ^ Qureshi, T. A.; Hunter, A.; Al-Diri, B. (June 2014). A Bayesian Framework for the Local Configuration of Retinal Junctions. 2014 IEEE Conference on Computer Vision and Pattern Recognition. pp. 3105–3110. CiteSeerX 10.1.1.1026.949. doi:10.1109/cvpr.2014.397. ISBN 978-1-4799-5118-5. S2CID 14654500.
- ^ Adar SD, Klein R, Klein BE, Szpiro AA, Cotch MF, Wong TY, et al. (2010). "Air Pollution and the microvasculature: a crosssectional assessment of in vivo retinal images in the population based multiethnic study of atherosclerosis (MESA)". PLOS Med. 7 (11): e1000372. doi:10.1371/journal.pmed.1000372. PMC 2994677. PMID 21152417.
- ^ Louwies, Tijs; Panis, Luc Int; Kicinski, Michal; Boever, Patrick De; Nawrot, Tim S. (2013). "Retinal Microvascular Responses to Short-Term Changes in Particulate Air Pollution in Healthy Adults". Environmental Health Perspectives. 121 (9): 1011–1016. doi:10.1289/ehp.1205721. PMC 3764070. PMID 23777785.
- ^ Tso, Mark O.M.; Jampol, Lee M. (1982). "Pathophysiology of Hypertensive Retinopathy". Ophthalmology. 89 (10): 1132–1145. doi:10.1016/s0161-6420(82)34663-1. PMID 7155524.
- ^ Chapman, N.; Dell'omo, G.; Sartini, M. S.; Witt, N.; Hughes, A.; Thom, S.; Pedrinelli, R. (1 August 2002). "Peripheral vascular disease is associated with abnormal arteriolar diameter relationships at bifurcations in the human retina". Clinical Science. 103 (2): 111–116. doi:10.1042/cs1030111. ISSN 0143-5221. PMID 12149100.
- ^ Patton, N.; Aslam, T.; MacGillivray, T.; Deary, I.; Dhillon, B.; Eikelboom, R.; Yogesan, K.; Constable, I. (2006). "Retinal image analysis: Concepts, applications and potential". Progress in Retinal and Eye Research. 25 (1): 99–127. doi:10.1016/j.preteyeres.2005.07.001. PMID 16154379. S2CID 7434103.
- ^ Wong TY, Knudtson MD, Klein R, Klein BE, Meuer SM, Hubbard LD (2004). "Computer assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors". Ophthalmology. 111 (6): 1183–1190. doi:10.1016/j.ophtha.2003.09.039. PMID 15177969.
- ^ Handbook of visual display technology. Chen, Janglin., Cranton, Wayne., Fihn, Mark. (2nd ed.). Cham, Switzerland: Springer. 2016. ISBN 9783319143460. OCLC 962009228.CS1 maint: others (link)
- ^ Retina (4th ed.). Philadelphia: Elsevier/Mosby. 2006. pp. 2013–2015. ISBN 978-0-323-02598-0. OCLC 62034580.
- ^ Guyton and Hall Physiology. p. 609.
- ^ Guyton and Hall Physiology. p. 612.
- ^ Seeing into the Future Ingenia, March 2007
- ^ Seidelmann, SB; et al. (1 November 2016). "Retinal Vessel Calibers in Predicting Long-Term Cardiovascular Outcomes". Circulation. 134 (18): 1328–1338. doi:10.1161/CIRCULATIONAHA.116.023425. PMC 5219936. PMID 27682886.
- ^ Querques, G; et al. (11 January 2019). "Functional and morphological changes of the retinal vessels in Alzheimer's disease and mild cognitive impairment". Scientific Reports. 9 (63): 63. Bibcode:2019NatSR...9...63Q. doi:10.1038/s41598-018-37271-6. PMC 6329813. PMID 30635610.
- ^ Dinculescu Astra; Glushakova Lyudmyla; Seok-Hong Min; Hauswirth William W (2005). "Adeno-associated virus-vectored gene therapy for retinal disease". Human Gene Therapy. 16 (6): 649–663. doi:10.1089/hum.2005.16.649. PMID 15960597.
- ^ a b c Cideciyan A. V.; Hauswirth W. W.; Aleman T. S.; Kaushal S.; Schwartz S. B.; Boye S. L.; Windsor E. A. M.; et al. (2009). "Human RPE65 gene therapy for Leber congenital amaurosis: persistence of early visual improvements and safety at 1 year". Human Gene Therapy. 20 (9): 999–1004. doi:10.1089/hum.2009.086. PMC 2829287. PMID 19583479.
- ^ a b c Simonelli F.; Maguire A. M.; Testa F.; Pierce E. A.; Mingozzi F.; Bennicelli J. L.; Rossi S.; et al. (2010). "Gene therapy for Leber's congenital amaurosis is safe and effective through 1.5 years after vector administration". Molecular Therapy. 18 (3): 643–650. doi:10.1038/mt.2009.277. PMC 2839440. PMID 19953081.
- ^ a b Maguire A. M.; Simonelli F.; Pierce E. A.; Pugh E. N.; Mingozzi F.; Bennicelli J.; Banfi S.; et al. (2008). "Safety and efficacy of gene transfer for Leber's congenital amaurosis". The New England Journal of Medicine. 358 (21): 2240–2248. doi:10.1056/NEJMoa0802315. PMC 2829748. PMID 18441370.
- ^ a b Maguire A. M.; High K. A.; Auricchio A.; Wright J. F.; Pierce E. A.; Testa F.; Mingozzi F.; et al. (2009). "Age-dependent effects of RPE65 gene therapy for Leber's congenital amaurosis: a phase 1 dose-escalation trial". Lancet. 374 (9701): 1597–1605. doi:10.1016/S0140-6736(09)61836-5. PMC 4492302. PMID 19854499.
- ^ Bainbridge J. W. B.; Smith A. J.; Barker S. S.; Robbie S.; Henderson R.; Balaggan K.; Viswanathan A.; et al. (2008). "Effect of gene therapy on visual function in Leber's congenital amaurosis" (PDF). The New England Journal of Medicine. 358 (21): 2231–2239. CiteSeerX 10.1.1.574.4003. doi:10.1056/NEJMoa0802268. PMID 18441371. Archived (PDF) from the original on 11 August 2017.
- ^ Hauswirth W. W.; Aleman T. S.; Kaushal S.; Cideciyan A. V.; Schwartz S. B.; Wang L.; Conlon T. J.; et al. (2008). "Treatment of Leber Congenital Amaurosis Due to RPE65Mutations by Ocular Subretinal Injection of Adeno-Associated Virus Gene Vector: Short-Term Results of a Phase I Trial". Human Gene Therapy. 19 (10): 979–990. doi:10.1089/hum.2008.107. PMC 2940541. PMID 18774912.
- ^ Ashtari M.; Cyckowski L. L.; Monroe J. F.; Marshall K. A.; Chung D. C.; Auricchio A.; Simonelli F.; et al. (2011). "The human visual cortex responds to gene therapy-mediated recovery of retinal function". The Journal of Clinical Investigation. 121 (6): 2160–2168. doi:10.1172/JCI57377. PMC 3104779. PMID 21606598.
- ^ Bennett J (2003). "Immune response following intraocular delivery of recombinant viral vectors". Gene Therapy. 10 (11): 977–982. doi:10.1038/sj.gt.3302030. PMID 12756418.
- ^ Curace Enrico M.; Auricchio Alberto (2008). "Versatility of AAV vectors for retinal gene transfer". Vision Research. 48 (3): 353–359. doi:10.1016/j.visres.2007.07.027. PMID 17923143. S2CID 9926758.
- ^ den Hollander, Anneke I.; Roepman, Ronald; Koenekoop, Robert K.; Cremers, Frans P.M. (2008). "Leber congenital amaurosis: Genes, proteins and disease mechanisms". Progress in Retinal and Eye Research. 27 (4): 391–419. doi:10.1016/j.preteyeres.2008.05.003. PMID 18632300. S2CID 30202286.
- ^ a b Rolling, F. (2004). "Recombinant AAV-mediated gene transfer to the retina: gene therapy perspectives". Gene Therapy. 11 (S1): S26–S32. doi:10.1038/sj.gt.3302366. ISSN 0969-7128. PMID 15454954.
- ^ "Santiago Ramón y Cajal – Biographical". www.nobelprize.org. Archived from the original on 6 October 2015. Retrieved 20 October 2015.
- ^ "Nobelprize.org". nobelprize.org. Archived from the original on 30 June 2017. Retrieved 5 December 2017.
- ^ "Calculating the speed of sight". newscientist.com. Archived from the original on 31 May 2015. Retrieved 5 December 2017.
- ^ MacLaren, RE; Pearson, RA; MacNeil, A; et al. (November 2006). "Retinal repair by transplantation of photoreceptor precursors" (PDF). Nature. 444 (7116): 203–7. Bibcode:2006Natur.444..203M. doi:10.1038/nature05161. hdl:2027.42/62596. PMID 17093405. S2CID 4415311.
- ^ Bartsch, U.; Oriyakhel, W.; Kenna, P. F.; Linke, S.; Richard, G.; Petrowitz, B.; Humphries, P.; Farrar, G. J.; Ader, M. (2008). "Retinal cells integrate into the outer nuclear layer and differentiate into mature photoreceptors after subretinal transplantation into adult mice". Experimental Eye Research. 86 (4): 691–700. doi:10.1016/j.exer.2008.01.018. PMID 18329018.
- ^ "About: EyeWire". Archived from the original on 13 February 2012. Retrieved 26 March 2012.
- ^ "Retina << EyeWire". Archived from the original on 24 March 2012. Retrieved 27 March 2012.
- ^ "EyeWire". Archived from the original on 24 April 2012. Retrieved 27 March 2012.
Further reading[edit]
- S. Ramón y Cajal, Histologie du Système Nerveux de l'Homme et des Vertébrés, Maloine, Paris, 1911.
- Rodieck RW (1965). "Quantitative analysis of cat retinal ganglion cell response to visual stimuli". Vision Res. 5 (11): 583–601. doi:10.1016/0042-6989(65)90033-7. PMID 5862581.
- Wandell, Brian A. (1995). Foundations of vision. Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-853-7.
- Wässle H, Boycott BB (1991). "Functional architecture of the mammalian retina". Physiol. Rev. 71 (2): 447–480. doi:10.1152/physrev.1991.71.2.447. PMID 2006220.
- Schulz HL, Goetz T, Kaschkoetoe J, Weber BH (2004). "The Retinome – Defining a reference transcriptome of the adult mammalian retina/retinal pigment epithelium". BMC Genomics (about a transcriptome for eye colour). 5 (1): 50. doi:10.1186/1471-2164-5-50. PMC 512282. PMID 15283859.
- Dowling, John (2007). "Retina". Scholarpedia. 2 (12): 3487. Bibcode:2007SchpJ...2.3487D. doi:10.4249/scholarpedia.3487.
- Khoshbin-e-Khoshnazar, M.R. (2014). "Quantum Superposition in the Retina:Evidences and Proposals". NeuroQuantology. 12 (1): 97–101. doi:10.14704/nq.2014.12.1.685.[unreliable source?]
External links[edit]
- Histology of the Eye, edited by William Krause, Dept. Pathology and Anatomical science, University of Missouri School of Medicine
- Eye, Brain, and Vision – online book – by David Hubel
- Kolb, H., Fernandez, E., & Nelson, R. (2003). Webvision: The neural organization of the vertebrate retina. Salt Lake City, Utah: John Moran Eye Center, University of Utah. Retrieved 22 July 2014.
- Demo: Artificial Retina, MIT Technology Review, September 2004. Reports on implant research at Technology Review
- Successful photoreceptor transplantation, MIT Technology Review, November 2006. How stem cells might restore sight Technology Review
- Australian Vision Prosthesis Group, Graduate School of Biomedical Engineering, University of New South Wales
- RetinaCentral, Genetics and Diseases of the Human Retina at University of Würzburg
- Retinal layers image. NeuroScience 2nd Ed at United States National Library of Medicine
- Jeremy Nathans's Seminars: "The Vertebrate Retina: Structure, Function, and Evolution"
- Retina – Cell Centered Database
- Histology image: 07901loa – Histology Learning System at Boston University
- MedlinePlus Encyclopedia: 002291
