| Имена | |||
|---|---|---|---|
| Название ИЮПАК Бромид серебра (I) | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.160 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII | |||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| AgBr | |||
| Молярная масса | 187,77 г / моль | ||
| Внешность | Бледно-желтый твердый светочувствительный элемент | ||
| Плотность | 6,473 г / см 3 , твердый | ||
| Температура плавления | 432 ° С (810 ° F, 705 К) | ||
| Точка кипения | 1,502 ° C (2,736 ° F, 1,775 К) (разлагается) | ||
| 0,140 мг / л (20 ° С) | |||
Произведение растворимости ( K уд ) | 5,4 × 10 −13 | ||
| Растворимость | не растворим в спирте , большинство кислот умеренно растворим в аммиаке растворим в растворах цианидов щелочных металлов | ||
| Ширина запрещенной зоны | 2,5 эВ | ||
| Электронная подвижность | 4000 см 2 / (В · с) | ||
| −59,7 · 10 −6 см 3 / моль | |||
Показатель преломления ( n D ) | 2,253 | ||
| Термохимия | |||
Теплоемкость ( C ) | 270 Дж / (кг · К) | ||
Стандартная мольная энтропия ( S | 107 Дж · моль −1 · K −1 [1] | ||
Std энтальпия формации (Δ F H ⦵ 298 ) | −100 кДж · моль −1 [1] | ||
| Опасности | |||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Предупреждение | ||
Положения об опасности GHS | H400 , H410 | ||
Меры предосторожности GHS | P273 , P391 , P501 | ||
| Родственные соединения | |||
Другие анионы | Фторид серебра (I) Хлорид серебра Иодид серебра | ||
Другие катионы | Бромид меди (I) Бромид ртути (I) | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Бромид серебра (AgBr), мягкая, бледно-желтая, нерастворимая в воде соль, хорошо известная (наряду с другими галогенидами серебра) своей необычной чувствительностью к свету . Это свойство позволило галогенидам серебра стать основой современных фотоматериалов. [2] AgBr широко используется в фотопленках и, как полагают некоторые, был использован для изготовления Туринской плащаницы . [3] Соль встречается в природе как минерал бромаргирит .
Подготовка [ править ]
Хотя соединение может быть найдено в минеральной форме, AgBr обычно получают реакцией нитрата серебра с бромидом щелочного металла, обычно бромидом калия : [2]
- AgNO 3 (водн.) + KBr (водн.) → AgBr (s) + KNO 3 (водн.)
Хотя это менее удобно, соль также можно приготовить непосредственно из ее элементов.
Современная подготовка простой светочувствительной поверхности включает формирование эмульсии кристаллов галогенида серебра в желатине, которую затем наносят на пленку или другую основу. Кристаллы образуются путем осаждения в контролируемой среде с образованием небольших однородных кристаллов (обычно <1 мкм в диаметре и содержащих ~ 10 12 атомов Ag), называемых зернами. [2]
Реакции [ править ]
Бромид серебра легко реагирует с жидким аммиаком с образованием различных комплексов аммиака, таких как Ag (NH
3)
2Br и Ag (NH
3)
2Br-
2. В общем: [4]
- AgBr + m NH 3 + (n - 1) Br-
→ Ag (NH
3)
мBr1-н
н
Бромид серебра реагирует с трифенилфосфином с образованием трис (трифенилфосфин) продукта: [5]
Физические свойства [ править ]
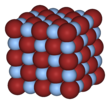
Кристаллическая структура [ править ]
Все AgF, AgCl и AgBr имеют гранецентрированную кубическую (ГЦК) структуру решетки каменной соли (NaCl) со следующими параметрами решетки: [6]
| Сложный | Кристалл | Структура | Решетка, а / Å | ||||
| AgF | fcc | каменная соль, NaCl | 4,936 | ||||
| AgCl, хлораргирит | fcc | каменная соль, NaCl | 5,5491 | ||||
| AgBr, бромаргирит | fcc | каменная соль, NaCl | 5,7745 | ||||
| |||||||
Более крупные ионы галогенидов расположены в кубической плотной упаковке, в то время как более мелкие ионы серебра заполняют октаэдрические промежутки между ними, образуя 6-координатную структуру, в которой ион серебра Ag + окружен ионами 6 Br - , и наоборот. Координационная геометрия AgBr в структуре NaCl является неожиданной для Ag (I), который обычно образует линейные, тригональные (3-координированный Ag) или тетраэдрический (4-координированный Ag) комплексы.
В отличие от других галогенидов серебра, иодаргирит (AgI) содержит гексагональную решетчатую структуру цинкита.
Растворимость [ править ]
Галогениды серебра имеют широкий диапазон растворимости. Растворимость AgF примерно в 6 × 10 7 раз выше, чем растворимость AgI. Эти различия объясняются относительными энтальпиями сольватации галогенид-ионов; энтальпия сольватации фторида аномально велика. [7]
| Сложный | Растворимость (г / 100 г H 2 O) |
| AgF | 172 |
| AgCl | 0,00019 |
| AgBr | 0,000014 |
| AgI | 0,000003 |
Фоточувствительность [ править ]
Хотя фотографические процессы развивались с середины 1800-х годов, подходящих теоретических объяснений не было до 1938 года, когда была опубликована статья RW Gurney и NF Mott. [8] Эта статья вызвала большое количество исследований в области химии и физики твердого тела, а также, в частности, в области фоточувствительности галогенида серебра. [2]
Дальнейшие исследования этого механизма показали, что фотографические свойства галогенидов серебра (в частности, AgBr) являются результатом отклонений от идеальной кристаллической структуры. Такие факторы, как рост кристаллов, примеси и дефекты поверхности, влияют на концентрацию точечных ионных дефектов и электронных ловушек, которые влияют на чувствительность к свету и позволяют формировать скрытое изображение . [3]
- Дефекты Френкеля и квадрополярная деформация
Основным дефектом в галогенидах серебра является дефект Френкеля , где ионы серебра расположены в межузельном пространстве (Ag i + ) в высокой концентрации с соответствующими им отрицательно заряженными вакансиями ионов серебра (Ag v - ). Уникальность пар AgBr Френкеля заключается в том, что межузельный Ag i + исключительно подвижен и его концентрация в слое под поверхностью зерна (называемом слоем пространственного заряда) намного превышает таковую в собственном объеме. [3] [9] Энергия образования пары Френкеля мала и составляет 1,16 эВ., а энергия активации миграции необычно низка при 0,05 эВ (по сравнению с NaCl: 2,18 эВ для образования пары Шоттки и 0,75 эВ для катионной миграции). Эти низкие энергии приводят к большой концентрации дефектов, которая может достигать около 1% вблизи точки плавления. [9]
Низкая энергия активации в бромиде серебра может быть объяснена высокой квадрупольной поляризуемостью ионов серебра; то есть он может легко деформироваться из сферы в эллипсоид. Это свойство, являющееся результатом электронной конфигурации d 9 иона серебра, облегчает миграцию как в ионе серебра, так и в вакансиях иона серебра, что дает необычно низкую энергию миграции (для Ag v - : 0,29–0,33 эВ по сравнению с 0,65 эВ для NaCl). [9]
Исследования показали, что на концентрацию дефектов сильно влияет (до нескольких кратных 10) размер кристаллов. Большинство дефектов, таких как концентрация межузельных ионов серебра и изгибы поверхности, обратно пропорциональны размеру кристалла, хотя вакансионные дефекты прямо пропорциональны. Это явление объясняется изменениями в химическом равновесии поверхности и, таким образом, по-разному влияет на концентрацию дефектов. [3]
Концентрацию примесей можно контролировать путем роста кристаллов или прямого добавления примесей в растворы кристаллов. Хотя примеси в решетке бромида серебра необходимы для стимулирования образования дефектов Френкеля, исследования Гамильтона показали, что выше определенной концентрации примесей количество дефектов межузельных ионов серебра и положительных перегибов резко уменьшается на несколько порядков. После этого становятся заметными только вакансионные дефекты ионов серебра, которые фактически увеличиваются на несколько порядков. [3]
- Электронные ловушки и дырочные ловушки
Когда свет падает на поверхность зерна галогенида серебра, фотоэлектрон генерируется, когда галогенид теряет свой электрон в зону проводимости: [2] [3] [10]
- X - + hν → X + e -
После того, как электрон высвобождается, он будет совмещать с интерстициальным Ag я + , чтобы создать атом серебра металла Ag я 0 : [2] [3] [10]
- е - + Ag i + → Ag i 0
Благодаря дефектам в кристалле электрон может уменьшить свою энергию и попасть в атом. [2] Степень границ зерен и дефектов в кристалле влияет на время жизни фотоэлектрона, где кристаллы с большой концентрацией дефектов будут захватывать электрон намного быстрее, чем более чистый кристалл. [10]
При мобилизации фотоэлектрона также образуется фотоотверстие h •, которое также необходимо нейтрализовать. Однако время жизни фотоотверстия не коррелирует со временем жизни фотоэлектрона. Эта деталь предполагает другой механизм захвата; Малиновский предполагает, что ловушки дырок могут быть связаны с дефектами из-за примесей. [10] После захвата дырки притягивают подвижные отрицательно заряженные дефекты в решетке: межузельная вакансия серебра Ag v - : [10]
- h • + Ag v - ⇌ h.Ag v
Образование h.Ag v снижает его энергию в достаточной степени, чтобы стабилизировать комплекс и уменьшить вероятность выброса дырки обратно в валентную зону (константа равновесия дырочного комплекса внутри кристалла оценивается как 10 −4 . [10]
Дополнительные исследования по улавливанию электронов и дырок показали, что примеси также могут быть важной системой улавливания. Следовательно, межузельные ионы серебра не могут быть восстановлены. Следовательно, эти ловушки на самом деле являются механизмами потерь и считаются неэффективными. Например, атмосферный кислород может взаимодействовать с фотоэлектронами с образованием разновидностей O 2 - , которые могут взаимодействовать с дыркой, обращая комплекс и подвергаясь рекомбинации. Примеси ионов металлов, такие как медь (I), железо (II) и кадмий (II), продемонстрировали захват дырок в бромиде серебра. [3]
- Химия поверхности кристаллов;
Как только дырочные комплексы образуются, они диффундируют к поверхности зерна в результате образовавшегося градиента концентрации. Исследования показали, что время жизни дырок у поверхности зерна намного больше, чем у дырок в объеме, и что эти дырки находятся в равновесии с адсорбированным бромом. Чистый эффект - это равновесный толчок на поверхности для образования большего количества дырок. Следовательно, когда дырочные комплексы достигают поверхности, они диссоциируют: [10]
- h.Ag v - → h • + Ag v - → Br → ДОЛЯ Br 2
Благодаря этому реакционному равновесию дырочные комплексы постоянно расходуются на поверхности, которая действует как сток, до тех пор, пока они не будут удалены из кристалла. Этот механизм обеспечивает аналог восстановления межузельного Ag i + до Ag i 0 , давая общее уравнение: [10]
- AgBr → Ag + ФРАКЦИЯ Br 2
- Формирование скрытого изображения и фотография
Теперь, когда часть теории изложена, можно обсудить реальный механизм фотографического процесса. Подводя итог, можно сказать, что когда фотопленка подвергается воздействию изображения, фотоны, падающие на зерно, создают электроны, которые взаимодействуют с образованием металлического серебра. Больше фотонов, попадающих в конкретное зерно, будет производить большую концентрацию атомов серебра, содержащую от 5 до 50 атомов серебра (из ~ 10 12 атомов), в зависимости от чувствительности эмульсии. Теперь пленка имеет градиент концентрации пятнышек атомов серебра, основанный на различной интенсивности света по ее площади, создавая невидимое « скрытое изображение ». [2] [10]
Во время этого процесса на поверхности кристалла образуются атомы брома. Для сбора брома слой поверх эмульсии, называемый сенсибилизатором, действует как акцептор брома. [10]
Во время проявления пленки скрытое изображение усиливается добавлением химического вещества, как правило, гидрохинона , что избирательность уменьшает те зерна, которые содержат атомы серебра. Этот процесс, чувствительный к температуре и концентрации, полностью восстановит зерна до металлического серебра, усиливая скрытое изображение на порядок от 10 10 до 10 11 . Этот шаг демонстрирует преимущество и превосходство галогенидов серебра над другими системами: скрытого изображения, формирование которого занимает всего миллисекунды и которое является невидимым, достаточно для создания из него полного изображения. [2]
После проявления пленка «фиксируется», при этом оставшиеся соли серебра удаляются, чтобы предотвратить дальнейшее восстановление, оставляя на пленке «негативное» изображение. Используемый агент представляет собой тиосульфат натрия и реагирует согласно следующему уравнению: [2]
- AgX (s) + 2 Na 2 S 2 O 3 (водн.) → Na 3 [Ag (S 2 O 3 ) 2 ] (водн.) + NaX (водн.)
Неопределенное количество положительных отпечатков можно создать из негатива, пропустив через него свет и выполнив те же действия, описанные выше. [2]
Свойства полупроводников [ править ]
Поскольку бромид серебра нагревается в пределах 100 ° C от его точки плавления, график Аррениуса ионной проводимости показывает, что значение увеличивается и "поворачивается вверх". Другие физические свойства, такие как модули упругости, удельная теплоемкость и запрещенная зона электронов, также увеличиваются, что свидетельствует о приближении кристалла к нестабильности. [9] Такое поведение, типичное для полупроводника, объясняется температурной зависимостью образования дефектов Френкеля, и при нормировке на концентрацию дефектов Френкеля график Аррениуса линеаризуется. [9]
См. Также [ править ]
- Фотография
- Наука фотографии
- Хлорид серебра
Ссылки [ править ]
- ^ a b Zumdahl, Стивен С. (2009). Химические принципы 6-е изд . Компания Houghton Mifflin. п. A23. ISBN 978-0-618-94690-7.
- ^ a b c d e f g h i j k Гринвуд, Н. Н., Эрншоу, А. (1984). Химия элементов . Нью-Йорк: Permagon Press. С. 1185–87. ISBN 978-0-08-022057-4.CS1 maint: несколько имен: список авторов ( ссылка )
- ^ a b c d e f g h Гамильтон, Дж. Ф. (1974). «Физические свойства микрокристаллов галогенида серебра». Фотографическая наука и инженерия . 18 (5): 493–500.
- ^ Leden, I., Persson, G .; Перссон; Sjöberg; Плотина; Sjöberg; Тофт (1961). «Растворимость хлорида серебра и бромида серебра в водном аммиаке и образование смешанных комплексов галогенида серебра и аммиака» . Acta Chem. Сканд . 15 : 607–614. DOI : 10.3891 / acta.chem.scand.15-0607 .CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Энгельгардт, LM; Хили, ПК; Патрик, штат Вирджиния; Уайт, AH (1987). "Аддукты основания Льюиса соединений металлов (I) группы 11. XXX. Комплексы 3: 1 трифенилфосфина с галогенидами серебра (I)". Aust. J. Chem . 40 (11): 1873–1880. DOI : 10,1071 / CH9871873 .
- ^ Клаус С. & Calzaferri, G. (2003). «Зонные структуры галогенидов серебра AgF, AgCl и AgBr: сравнительное исследование». Photochem. Photobiol. Sci . 2 (4): 398–401. DOI : 10.1039 / b211678b .
- ^ Лиде, Дэвид Р. (редактор). (2005) Справочник по химии и физике , 86-е издание, The Chemical Rubber Publishing Co., Кливленд.
- ^ Герни, RW; Мотт, Н.Ф. (1938). «Теория фотолиза бромистого серебра и фотографическое скрытое изображение» . Proc. Рой. Soc. А164 (917): 151–167. Bibcode : 1938RSPSA.164..151G . DOI : 10.1098 / RSPA.1938.0011 .
- ^ a b c d e Слифкин, LM (1989). «Физика дефектов решетки в галогенидах серебра». Дефекты кристаллической решетки и аморфные материалы . 18 : 81–96.
- ^ a b c d e f g h i j Малиновский Дж. (1968). «Роль отверстий в фотографическом процессе». Журнал фотографической науки . 16 (2): 57–62. DOI : 10.1080 / 00223638.1968.11737436 .