 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Лотронекс |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a601230 |
| Пути администрирования | Пероральный ( таблетки ) |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетические данные | |
| Биодоступность | 50–60% |
| Связывание с белками | 82% |
| Метаболизм | Печеночные (включая CYP2C9 , CYP3A4 и CYP1A2 ) |
| Ликвидация Период полувыведения | 1,5–1,7 часов |
| Экскреция | Почечный 73%, фекальный 24% |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| CompTox Dashboard ( EPA ) | |
| Химические и физические данные | |
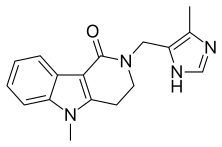
| Формула | C 17 H 18 N 4 O |
| Молярная масса | 294,358 г · моль -1 |
| 3D модель ( JSmol ) |
|
Улыбки
| |
ИнЧИ
| |
| (проверять) | |
Алосетрон , продаваемый, среди прочего, под торговой маркой Lotronex , представляет собой антагонист 5-HT 3, используемый только для лечения тяжелого синдрома раздраженного кишечника с преобладанием диареи (СРК) у женщин.
Он был запатентован в 1987 году и одобрен для медицинского использования в 2002 году. [1] В настоящее время он продается компанией Prometheus Laboratories Inc. ( Сан-Диего ). Алозетрон был снят с продажи в 2000 году из-за возникновения серьезных опасных для жизни побочных эффектов со стороны желудочно - кишечного тракта , но был повторно введен в продажу в 2002 году с ограничением доступности и использования.
Медицинское использование [ править ]
Алосетрон показан только женщинам с тяжелым синдромом раздраженного кишечника с преобладанием диареи (СРК-Д), у которых есть:
- хронические симптомы СРК (обычно продолжаются 6 месяцев или дольше),
- были исключены анатомические или биохимические аномалии желудочно-кишечного тракта, и
- не ответил адекватно на обычную терапию.
Тяжелая форма СРК-Д включает: диарею и 1 или несколько из следующих факторов:
- частые и сильные боли / дискомфорт в животе,
- частые позывы на кишечник или недержание кала,
- инвалидность или ограничение повседневной активности из-за СРК. [2]
Эффективность [ править ]
Исследование фазы III для утверждения было опубликовано в 2000 г. как финансируемое промышленностью рандомизированное плацебо-контролируемое исследование (PCT). Его авторы обнаружили, что 1 мг алозетрона, принимаемый перорально два раза в день в течение 12 недель, был связан с 12% (ДИ 4,7-19,2) улучшением облегчения боли в животе и дискомфорта, связанных с пациентами с преобладанием диареи. [3] В настоящее время в США утвержден рецепт на алозетрон в дозах 0,5 и 1 мг. [4]
В обзоре медицинского специалиста FDA от 4 ноября 1999 г. отмечается: «Пациенты, которые, по мнению исследователей, соответствуют подтипу с преобладанием диареи, на исходном уровне имели… значения консистенции стула, которые не были ни жидкими, ни водянистыми». [5] Консультативный комитет FDA по гастроинтестинальным препаратам назвал эффективность препарата «умеренной», подчеркнув, что плацебо помогло 40–50% женщин оценить первичный результат. [4]
Противопоказания [ править ]
В брошюре с информацией о назначениях Lotronex указано, что алозетрон не следует назначать пациентам с запорами. Другие противопоказания: хронические или тяжелые запоры в анамнезе или последствия запоров; кишечная непроходимость, стриктура , токсический мегаколон , перфорация и / или спайки желудочно-кишечного тракта, ишемический колит , нарушение кровообращения в кишечнике, тромбофлебит или состояние гиперкоагуляции; Болезнь Крона или язвенный колит ; дивертикулит ; тяжелая печеночная недостаточность. Одновременный прием флувоксамина также противопоказан. [2]
Побочные эффекты [ править ]
Алосетрон был отменен в 2000 году после того, как алозетрон ассоциировался с серьезными опасными для жизни побочными эффектами со стороны желудочно-кишечного тракта. Кумулятивная частота ишемического колита составляла 2 из 1000, в то время как серьезные осложнения, вызванные запором (непроходимость, перфорация, импакция , токсический мегаколон , вторичная ишемия толстой кишки , смерть ), составляли 1 из 1000. [2] Обзор 1999 года, проведенный врачом FDA Джоном. Сеньор указал, что 27% пациентов страдали запорами. [6]В исследовании фазы III сообщалось, что запор возник у 30% и 3% пациентов в группах алозетрона и плацебо, соответственно. Это было названо наиболее важной причиной выбывания пациентов из исследования. [3]
Механизм действия [ править ]
Алосетрон оказывает антагонистическое действие на рецепторы 5-HT 3 кишечной нервной системы желудочно-кишечного тракта. Будучи антагонистом 5-HT 3, как ондансетрон , он не классифицируется и не одобряется как противорвотное средство. Поскольку стимуляция рецепторов 5-HT 3 положительно коррелирует с перистальтикой желудочно-кишечного тракта, антагонизм алозетрона к 5-HT 3 замедляет движение фекалий через толстую кишку, увеличивая степень абсорбции воды и уменьшая влажность и объем оставшейся отходы. [2]
История [ править ]
Алосетрон был первоначально одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США 9 февраля 2000 г. [7] после семимесячного обзора. [8] Во время первоначального утверждения, обозреватели Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) обнаружили, что алозетрон улучшает симптомы у 10–20% пациентов. [9]
Отгрузка в аптеки началась в марте 2000 года. 17 июля медицинский работник подал в FDA отчет о смерти 50-летней женщины, страдающей мезентериальной ишемией . В отчете указано, что алозетрон был «главным подозреваемым» в смерти. [6]
Алосетрон был добровольно снят с продажи GlaxoWellcome 28 ноября 2000 г. из-за серьезных опасных для жизни побочных эффектов со стороны желудочно - кишечного тракта , в том числе 5 смертельных случаев и дополнительных операций на кишечнике. [8] FDA сообщило о 49 случаях ишемического колита и 21 случае «тяжелого запора», а также о том, что 10 из 70 пациентов перенесли операции, а еще 34 пациента были обследованы в больницах и выписаны без операции. К 17 ноября 2000 г. фармацевты выписали алосетрон на 474 115 рецептов. [8] Продолжали поступать сообщения о серьезных побочных эффектах, в результате которых было зарегистрировано 84 случая ишемического колита, 113 случаев тяжелого запора, 143 случая госпитализации и 7 смертей. [10]
Группы защиты интересов пациентов, в первую очередь Lotronex Action Group и Международный фонд функциональных желудочно-кишечных расстройств (IFFGD), лоббировали возвращение препарата. Другая группа по защите интересов пациентов, Public Citizen Health Research Group, выступила против повторного введения. [11] [4]
7 июня 2002 года FDA объявило об одобрении дополнительной заявки на новый лекарственный препарат (sNDA), которая позволяет ограниченный маркетинг Lotronex (алосетрона гидрохлорид) для лечения только женщин с тяжелым синдромом раздраженного кишечника с преобладанием диареи (IBS). [2] [12] [13] Строгие правила выписывания рецептов, первоначально введенные в 2002 году, были немного смягчены в 2016 году, что позволило выписывать электронные рецепты среди других преимуществ.
Неизвестно, подавался ли алозетрон на регистрацию в ЕС .
ГСК продал Lotronex в калифорнийской корпорации Прометея в конце 2007 года [14]
С 2015 года генерические версии алозетрона доступны в США и продаются рядом различных компаний, включая Actavis Pharma Company, Prometheus Laboratories и Sebela Pharmaceuticals Inc.
Критика FDA [ править ]
В 2001 годе редактор прославленного медицинского журнала The Lancet , Ричард Хортон , раскритикованный ФД алосетрона в необычно остром языке. [15] Хортон утверждал, что лечение нефатального состояния не оправдывает использование препарата с потенциально летальными побочными эффектами, и что FDA должно было отозвать разрешение на применение алозетрона раньше, когда постмаркетинговое наблюдение показало, что многие пациенты страдали запорами. необходимость хирургического вмешательства и ишемический колит. Он утверждал, что должностные лица FDA были ненадлежащим образом мотивированы поддерживать и восстанавливать разрешение на применение алозетрона из-за того, в какой степени Центр FDA по оценке и исследованиям лекарственных средствфинансируется за счет абонентских сборов, уплачиваемых производителями фармацевтической продукции, и что восстановление алозетрона было согласовано на конфиденциальных встречах с представителями GlaxoSmithKline .
В статье, опубликованной в British Medical Journal (BMJ), отмечалось: «Разрешая маркетинг алозетрона, препарата, который, по его собственным словам, представляет серьезную и значительную проблему для общественного здравоохранения, FDA провалило свою миссию». [16] Другие утверждали, что процесс утверждения Lotronex был примером нормативного захвата . [4]
Ссылки [ править ]
- ^ Fischer J, Ganellin CR (2006). Открытие лекарств на основе аналогов . Джон Вили и сыновья. п. 448. ISBN 9783527607495.
- ^ a b c d e «Таблетки Lotronex (алосетрона гидрохлорид). Полная информация по назначению» (PDF) . Prometheus Laboratories Inc., 9410 Carroll Park Drive, San Diego, CA 92121 . Проверено 14 февраля +2016 .
- ^ a b Камиллери M, Northcutt AR, Kong S, Dukes GE, McSorley D, Mangel AW (март 2000 г.). «Эффективность и безопасность алозетрона у женщин с синдромом раздраженного кишечника: рандомизированное плацебо-контролируемое исследование». Ланцет . 355 (9209): 1035–40. DOI : 10.1016 / S0140-6736 (00) 02033-X . PMID 10744088 . S2CID 31290668 .
- ^ a b c d Мойнихан Р. (сентябрь 2002 г.). «Алосетрон: пример использования регулирующих органов или победа за права пациентов?» . BMJ . 325 (7364): 592–5. DOI : 10.1136 / bmj.325.7364.592 . PMC 1124108 . PMID 12228140 .
- ^ Barbehenn E, Лурье P, Wolfe SM (декабрь 2000). «Алозетрон при синдроме раздраженного кишечника» . Ланцет . 356 (9246): 2009–10. DOI : 10.1016 / S0140-6736 (05) 72978-0 . PMID 11130544 . S2CID 30340322 .
- ^ a b Willman D (2 ноября 2000 г.). «Проблема безопасности Lotronex, сведенная к минимуму FDA» . Лос-Анджелес Таймс . Проверено 11 декабря 2012 года .
- ^ Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. «Детали препарата» . Проверено 11 декабря 2012 года .
- ↑ a b c Willman D (29 ноября 2000 г.). «Препарат Лотронекс преодолел опасения по поводу безопасности» . Лос-Анджелес Таймс . Проверено 11 декабря 2012 года .
- ^ Willman D (20 декабря 2000). «Офицер предвидел смертельные последствия» . Лос-Анджелес Таймс . Проверено 11 декабря 2012 года .
- ^ Центр оценки и исследования лекарственных средств (23 апреля 2002 г.). «Консультативный комитет по желудочно-кишечным препаратам и Подкомитет по безопасности лекарственных средств и управлению рисками Консультативного комитета по фармацевтическим наукам» (PDF) . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Проверено 11 декабря 2012 года .
- Перейти ↑ Grady D (23 апреля 2002 г.). «Апелляции побуждают Агентство США рассмотреть вопрос о разрешении продажи лекарства от диареи, связанного со смертельным исходом» . Нью-Йорк Таймс . Проверено 11 декабря 2012 года .
- ^ Поллак A (2006-03-09). «Группа FDA рекомендует лекарство от РС, несмотря на смертельный риск» . Нью-Йорк Таймс . Проверено 13 марта 2008 .
- ↑ Grady D (8 июня 2002 г.). «США возвращают на рынок наркотики, связанные с смертями» . Нью-Йорк Таймс . Проверено 11 декабря 2012 года .
- ^ Prometheus Laboratories Inc. Пресс - релиз от 7 ноября 2007 года архивной 2012-07-14 в Archive.today Проверено 27 августа 2008 года.
- Перейти ↑ Horton R (май 2001). «Lotronex и FDA: фатальная эрозия целостности». Ланцет . 357 (9268): 1544–5. DOI : 10.1016 / S0140-6736 (00) 04776-0 . PMID 11377636 . S2CID 10886502 .
- ^ Lievre M (сентябрь 2002). «Алозетрон при синдроме раздраженного кишечника» . BMJ . 325 (7364): 555–6. DOI : 10.1136 / bmj.325.7364.555 . PMC 1124090 . PMID 12228116 .