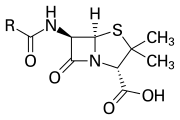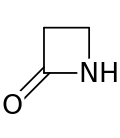
Бета-лакты ( β-лакты ) кольцо представляет собой четыре-членные лакты . [1] лакты представляют собой циклический амид , и бета - лактамы названы так потому , что атом азота присоединен к β-углеродному атом относительно карбонила. Самый простой возможный β-лактам - это 2-азетидинон . β-лактамы являются важными структурными единицами лекарственных средств [2] и обладают рядом фармакологических активностей. [3]
Клиническое значение [ править ]
Β-лактамное кольцо является частью основной структуры нескольких семейств антибиотиков , основными из которых являются пенициллины , цефалоспорины , карбапенемы и монобактамы , которые поэтому также называются β-лактамными антибиотиками . Почти все эти антибиотики действуют, подавляя биосинтез клеточной стенки бактерий . Это имеет летальный эффект для бактерий , хотя любая данная популяция бактерий обычно содержит подгруппу, устойчивую к β-лактамным антибиотикам. Бактериальная резистентность возникает в результате экспрессии одного из многих генов, продуцирующихβ-лактамазы , класс ферментов, которые разрывают β-лактамное кольцо. Более 1800 различных ферментов β-лактамазы были зарегистрированы у различных видов бактерий. [4] Эти ферменты широко различаются по своей химической структуре и каталитической эффективности. [5] Когда бактериальные популяции имеют эти устойчивые подгруппы, лечение β-лактамом может привести к тому, что устойчивый штамм станет более распространенным и, следовательно, более вирулентным. Антибиотики на основе β-лактама можно рассматривать как один из наиболее важных классов антибиотиков, но они склонны к клинической устойчивости. β-лактам проявляет свои антибиотические свойства, имитируя природный субстрат d-Ala-d-Ala для группы ферментов, известных как связывающие пенициллин белки.(PBP), которые имеют функцию поперечного сшивания пептидогликановой части клеточной стенки бактерий. [6]
История [ править ]
Первый синтетический β-лактама, получали Штаудингер в 1907 году путем реакции основания Шиффа из анилина и бензальдегида с дифенилкетен [7] [8] в [2 + 2] циклоприсоединения (Ph обозначает фенильную функциональную группу):
До 1970 года большинство исследований β-лактама касалось групп пенициллина и цефалоспоринов , но с тех пор было описано большое разнообразие структур. [9] [10]
Синтез и реакционная способность [ править ]
Разработано множество методов синтеза β-лактамов. [11] [12] [13] [14]
Breckpot β-лакты синтез [15] производит замещенные бета-лактамы на циклизации беты сложных эфиров аминокислот , путем использования реагента Гриньяра . [16] Реагент Мукаямы также используется в модифицированном синтезе Брекпота. [15]
Из-за деформации кольца β-лактамы легче гидролизуются, чем линейные амиды или более крупные лактамы. Этот штамм дополнительно увеличивается за счет слияния со вторым кольцом, что обнаруживается в большинстве β-лактамных антибиотиков. Эта тенденция связана с тем, что амидный характер β- лактама снижается за счет апланарности системы. Атом азота идеального амида является sp 2 -гибридизированным из-за резонанса , а sp 2 -гибридизованные атомы имеют тригональную плоскую геометрию связи . Поскольку геометрия пирамидальной связи навязывается атому азота деформацией кольца, резонанс амидной связи уменьшается, и карбонил становится более кетоновым.-нравиться. Нобелевский лауреат Роберт Бернс Вудворд описал параметр h как меру высоты тригональной пирамиды, определяемой азотом ( вершиной ) и тремя соседними атомами. h соответствует силе β-лактамной связи с более низкими числами (более плоскими, больше похожими на идеальные амиды), которые являются более сильными и менее реактивными. [17] Монобактамы имеют значения h от 0,05 до 0,10 ангстрем (Å). Цефемы имеют значения h в диапазоне 0,20–0,25 Å. Пенамы имеют значения в диапазоне 0,40–0,50 Å, в то время как карбапенемы и клавамы имеют значения 0,50–0,60 Å, являясь наиболее реактивными из β-лактамов по отношению к гидролизу. [18]
Другие приложения [ править ]
Новое исследование показало, что β-лактамы могут подвергаться полимеризации с раскрытием цикла с образованием амидных связей и превращаться в полимеры нейлона-3. Основы этих полимеров идентичны пептидам, что придает им биофункциональность. Эти полимеры нейлона-3 могут имитировать защитные пептиды хозяина или действовать как сигналы, стимулирующие функцию стволовых клеток 3T3 . [18]
Сообщалось также об антипролиферативных средствах , нацеленных на тубулин с β-лактамами в своей структуре. [19] [20]
См. Также [ править ]
- Азетидин
- Лактон
- Lectka энантиоселективный синтез бета-лактама
Ссылки [ править ]
- Перейти ↑ Gilchrist T (1987). Гетероциклическая химия . Харлоу: Longman Scientific. ISBN 978-0-582-01421-3.
- ^ Фишер, JF; Meroueh, SO; Mobashery, С. (2005). «Бактериальная резистентность к β-лактамным антибиотикам: неотразимый оппортунизм, неотразимая возможность». Химические обзоры . 105 (2): 395–424. DOI : 10.1021 / cr030102i . PMID 15700950 .
- ^ Каур, Раджниш; Сингх, Раман; Ахлават, Приянка; Кошик, Парул; Сингх, Калдип (07.01.2020). «Современные достижения в терапевтическом портфеле 2-азетидинонов» . Письма по химической биологии . 7 (1): 13–26.
- ↑ Brandt C, Braun SD, Stein C, Slickers P, Ehricht R, Pletz MW, Makarewicz O (февраль 2017 г.). «Анализ in silico serine β-лактамаз показывает огромный потенциал резистома у экологических и патогенных видов» . Научные отчеты . 7 : 43232. Bibcode : 2017NatSR ... 743232B . DOI : 10.1038 / srep43232 . PMC 5324141 . PMID 28233789 .
- ^ Ehmann ДЕ, Jahič Н, Росс ЛП, Гу РФ, Ху J, G Керн, Прогулочная зона ГК, Фишер SL (июль 2012). «Авибактам представляет собой ковалентный обратимый ингибитор не-β-лактамных β-лактамаз» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (29): 11663–8. Bibcode : 2012PNAS..10911663E . DOI : 10.1073 / pnas.1205073109 . PMC 3406822 . PMID 22753474 .
- ↑ Типпер DJ, Строминджер JL (октябрь 1965 г.). «Механизм действия пенициллинов: предложение, основанное на их структурном сходстве с ацил-D-аланил-D-аланином» . Труды Национальной академии наук Соединенных Штатов Америки . 54 (4): 1133–41. Bibcode : 1965PNAS ... 54.1133T . DOI : 10.1073 / pnas.54.4.1133 . PMC 219812 . PMID 5219821 .
- ^ Тидвелл TT (2008). «Хьюго (Уго) Шифф, основания Шиффа и век синтеза бета-лактама». Angewandte Chemie . 47 (6): 1016–20. DOI : 10.1002 / anie.200702965 . PMID 18022986 .
- ^ Штаудингер H (1907). "Zur Kenntniss der Ketene. Diphenylketen" . Justus Liebigs Ann. Chem . 356 (1–2): 51–123. DOI : 10.1002 / jlac.19073560106 .
- ^ Флинн EH (1972). Цефалоспорины и пенициллины: химия и биология . Нью-Йорк и Лондон: Academic Press.
- ^ Hosseyni S, Jarrahpour A (октябрь 2018). «Последние достижения в синтезе β-лактамов». Органическая и биомолекулярная химия . 16 (38): 6840–6852. DOI : 10.1039 / c8ob01833b . PMID 30209477 .
- ^ Alcaide, Бенито; Альмендрос, Педро; Арагончилло, Кристина (2007). «Β-лактамы: универсальные строительные блоки для стереоселективного синтеза не-β-лактамных продуктов». Химические обзоры . 107 (11): 4437–4492. DOI : 10.1021 / cr0307300 . PMID 17649981 .
- ^ Хоссейни, Сейедмореза; Джаррахпур, Алиасгар (2018). «Последние достижения в синтезе β-лактамов» . Органическая и биомолекулярная химия . 16 (38): 6840–6852. DOI : 10.1039 / C8OB01833B . ISSN 1477-0520 . PMID 30209477 .
- ^ Питтс, Коди Росс; Лектка, Томас (27.08.2014). «Химический синтез β-лактамов: асимметричный катализ и другие последние достижения» . Химические обзоры . 114 (16): 7930–7953. DOI : 10.1021 / cr4005549 . ISSN 0009-2665 . PMID 24555548 .
- ^ Халв, Ак; Дубей, Р.; Бхадаурия, Д; Бхаскар, Б; Бхадаурия, Р. (2006). «Синтез, антимикробный скрининг и взаимосвязь структура-активность некоторых новых 2-гидрокси-5- (нитрозамещенных фенилазо) бензилидин анилинов» . Индийский журнал фармацевтических наук . 68 (4): 510. DOI : 10,4103 / 0250-474X.27831 . ISSN 0250-474X .
- ^ a b "Breckpot β-Lactam Synthesis" , Комплексные реакции с органическими названиями и реагенты , Хобокен, Нью-Джерси, США: John Wiley & Sons, Inc., стр. conrr115, 2010-09-15, doi : 10.1002 / 9780470638859.conrr115 , ISBN 978-0-470-63885-9, получено 2021-02-04
- ^ Богданов В, Zdravkovski Z, Hristovski К. "Breckpot Синтез" . Институт химии Скопье .
- ^ Woodward RB (май 1980). «Пенемы и родственные вещества» . Философские труды Лондонского королевского общества. Серия B, Биологические науки . 289 (1036): 239–50. Bibcode : 1980RSPTB.289..239W . DOI : 10.1098 / rstb.1980.0042 . PMID 6109320 .
- ^ a b Nangia A, Biradha K, Desiraju GR (1996). «Корреляция биологической активности β-лактамных антибиотиков со структурными параметрами Вудворда и Коэна: исследование базы данных Кембриджа». J. Chem. Soc. Perkin Trans . 2 (5): 943–53. DOI : 10.1039 / p29960000943 .
- ^ О'Бойл Н.М., Карр M, Greene LM, Bergin O, Nathwani SM, МакКейб T, Lloyd DG, Zisterer DM, Meegan MJ (декабрь 2010). «Синтез и оценка азетидиноновых аналогов комбретастатина А-4 в качестве нацеленных на тубулин агентов» . Журнал медицинской химии . 53 (24): 8569–84. DOI : 10.1021 / jm101115u . hdl : 2262/81779 . PMID 21080725 .
- ^ О'Бойл Н.М., Greene Л.М., Bergin O, Fichet JB, МакКейб T, Lloyd DG, Zisterer DM, Meegan MJ (апрель 2011). «Синтез, оценка и структурные исследования антипролиферативных тубулин-направленных азетидин-2-онов» (PDF) . Биоорганическая и медицинская химия . 19 (7): 2306–25. DOI : 10.1016 / j.bmc.2011.02.022 . hdl : 2262/54923 . PMID 21397510 .
Внешние ссылки [ править ]
- Синтез β-лактамов