 | |
 | |
| Клинические данные | |
|---|---|
| Пути администрирования | Пероральный, сублингвальный, инсуффляционный, внутривенный |
| Код УВД |
|
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетические данные | |
| Метаболизм | Печеночные ( CYP широко вовлечен) |
| Экскреция | Почечный |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ЧЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| ECHA InfoCard | 100.230.706 |
| Химические и физические данные | |
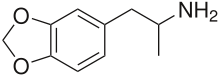
| Формула | C 10 H 13 N O 2 |
| Молярная масса | 179,219 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
| | |
3,4-метиленовый
МДА редко используется в качестве рекреационного наркотика по сравнению с другими наркотиками из семейства амфетаминов; однако, она остается важным и широко используемый препарат из - за его основной метаболит, [1] продукт печеночной N-деалкилирование, [2] из МДМА (экстази), Кроме того, он является общим для поиска MDA как примесь незаконно производимого МДМА. [3] [4]
Использует [ редактировать ]
Медицинский [ править ]
В настоящее время MDA не применяется в медицине.
Развлекательный [ править ]
Несмотря на то, что MDA является незаконным, его покупают, продают и используют в качестве развлекательного «наркотика для любви» из-за его улучшения настроения и сочувствия . [5] Рекреационная доза МДА иногда составляет от 100 до 160 мг. [6]
Побочные эффекты [ править ]
MDA вызывает серотонинергические нейротоксические эффекты [7] [8], которые, как считается, активируются начальным метаболизмом MDA. [2] Кроме того, MDA активирует ответ нейроглии , хотя после использования он проходит. [7]
Передозировка [ править ]
Симптомы острой токсичности могут включать возбуждение , потоотделение , повышение артериального давления и частоты сердечных сокращений , резкое повышение температуры тела , судороги и смерть . Смерть обычно вызывается сердечными приступами и последующим кровоизлиянием в мозг ( инсульт ). [9] [ требуется медицинская ссылка ]
Взаимодействия [ править ]
Этот раздел пуст. Вы можете помочь, добавив к нему . ( Апрель 2017 г. ) |
Фармакология [ править ]
Фармакодинамика [ править ]
МДА является субстратом из серотонина , норадреналина , допамина и везикулярный транспортер моноаминов , а также TAAR1 агониста , [10] и по этим причинам действует как ингибитор обратного захвата и смазывающего средства от серотонина , норадреналина и дофамина (то есть, это SNDRA ). [11] Он также является агонистом серотонина 5-HT 2A , [12] 5-HT 2B , [13]и 5-НТ 2С рецепторов [14] и показывает сродство к & alpha ; 2A - , α 2B - и α 2С адренергических рецепторов и серотонина 5-HT 1A и 5-HT 7 рецепторы . [15]
( S ) - оптический изомер MDA более эффективен, чем ( R ) - оптический изомер в качестве психостимулятора, обладая большим сродством к трем переносчикам моноаминов .
Что касается субъективных и поведенческих эффектов MDA, считается, что высвобождение серотонина требуется для его эмпатоген-энтактогенового эффекта, высвобождение дофамина и норэпинефрина отвечает за его психостимулирующие эффекты, высвобождение дофамина необходимо для его эйфории ( вознаграждения и привыкания ) эффекты, и прямой агонизм рецептора серотонина 5-HT 2A является причиной его психоделических эффектов. [ требуется медицинская цитата ]
Фармакокинетика [ править ]
Сообщается, что продолжительность приема препарата составляет от 6 до 8 часов. [6]
Химия [ править ]
MDA представляет собой замещенный метилендиоксилированный фенэтиламин и производное амфетамина . По отношению к другим фенэтиламинов и амфетамины, это 3,4-метилендиокси, α-метил производное бета-фенилэтиламин , 3,4-метилендиокси производное амфетамина , а N - десметил производное МДМА.
Синонимы [ править ]
Помимо 3,4-метилендиоксиамфетамина , MDA также известен под другими химическими синонимами, такими как следующие:
- α-Метил-3,4-метилендиокси-β-фенилэтиламин
- 1- (3,4-метилендиоксифенил) -2-пропанамин
- 1- (1,3-Бензодиоксол-5-ил) -2-пропанамин
Синтез [ править ]
МДА обычно синтезируется из эфирных масел, таких как сафрол или пиперональ . Общие подходы к этим предшественникам включают:
- Реакция Сафрола в алкене функциональной группы с галогеном , содержащими минеральную кислотой с последующей аминным алкилированием . [16] [17]
- Окисление сафрола по Ваккеру с образованием 3,4-метилендиоксифенилпропан-2-она (MDP2P) с последующим восстановительным аминированием [17] [18] или восстановлением его оксима . [19]
- Реакция Генри пипероналя с нитроэтаном с последующим восстановлением нитросоединения . [17] [20] [21] [22] [23]
- Реакция Дарценса на гелиотропин была также проведена J. Elks и соавт. [24] Это дает MDP2P , который затем подвергали реакции Лейкарта.
Обнаружение в биологических жидкостях [ править ]
Количество MDA может быть определено в крови, плазме или моче для мониторинга использования, подтверждения диагноза отравления или помощи в судебно-медицинском расследовании дорожно-транспортного происшествия или другого уголовного правонарушения или внезапной смерти. В некоторых программах проверки на злоупотребление наркотиками в качестве образцов используются волосы, слюна или пот. Большинство коммерческих скрининговых тестов иммуноанализа амфетамина значительно перекрестно реагируют с МДА и основными метаболитами МДМА, но хроматографические методы позволяют легко различить и отдельно измерить каждое из этих веществ. Концентрации МДА в крови или моче человека, принимавшего только МДМА, обычно составляют менее 10% от концентрации исходного препарата. [25] [26] [27]
Производные [ править ]
MDA составляет часть основной структуры протокилола, агониста β-адренергических рецепторов .
История [ править ]
MDA был первым синтезированный по С. Манниха и В. Якобсон в 1910 году [19] Он был первым попадет в июле 1930 года Гордон Alles , который впоследствии лицензированный препарат для Smith, Kline & французский . [28] MDA впервые был использован в испытаниях на животных в 1939 году, а испытания на людях начались в 1941 году с целью изучения возможных методов лечения болезни Паркинсона . С 1949 по 1957 год более 500 человек получали MDA в ходе исследования его потенциального использования в качестве антидепрессанта и / или аноректика, проведенного Smith, Kline & French . Армия Соединенных Штатовтакже экспериментировал с наркотиком под кодовым названием EA-1298, работая над созданием лекарства правды или агента, выводящего из строя. Гарольд Блауэр [29] умер в январе 1953 года после внутривенной инъекции без его ведома и согласия 450 мг препарата в рамках проекта MKUltra . MDA был запатентован компанией Smith, Kline & French в качестве атарактика в 1960 году, а в качестве аноректического средства под торговым названием «амфедоксамин» в 1961 году. MDA начал появляться на арене рекреационных наркотиков примерно с 1963 по 1964 год. Тогда он был недорогим и легко доступным. в качестве исследовательского химического вещества от нескольких научных поставщиков. Несколько исследователей, в том числеКлаудио Наранхо и Ричард Йенсен исследовали MDA в области психотерапии . [30] [31]
Общество и культура [ править ]
Имя [ редактировать ]
Когда MDA разрабатывался как потенциальный фармацевтический препарат, ему было дано международное непатентованное название (INN) тенамфетамина .
Правовой статус [ править ]
Австралия [ править ]
MDA входит в список 9 запрещенных веществ в соответствии со стандартами ядовитых веществ . [32] Вещество, указанное в Таблице 9, указано как «Вещества, которыми можно злоупотреблять или использовать не по назначению, производство, владение, продажа или использование которых должны быть запрещены законом, за исключением случаев, когда это требуется для медицинских или научных исследований, или для аналитических, обучающих или в целях обучения с одобрения органов здравоохранения Содружества и / или штата или территории ". [32]
Соединенные Штаты [ править ]
MDA является Schedule I регулируемого вещества в США.
Исследование [ править ]
В 2010 году изучалась способность MDA вызывать мистические переживания и изменять зрение у здоровых добровольцев. Исследование пришло к выводу, что MDA является «потенциальным инструментом для исследования мистических переживаний и визуального восприятия []». [6]
Ссылки [ править ]
- ^ Crean, RD; Дэвис, С.А.; Von Huben, SN; Lay, CC; Катнер, С. Н.; Таффе, Массачусетс (13 октября 2006 г.). «Влияние (±) 3,4-метилендиоксиметамфетамина, (±) 3,4-метилендиоксиамфетамина и метамфетамина на температуру и активность у макак-резусов» . Неврология . 142 (2): 515–525. DOI : 10.1016 / j.neuroscience.2006.06.033 . PMC 1853374 . PMID 16876329 .
- ^ а б де ла Торре, R; Фарре, М; Roset, Pn; Пиццаро, N; Abanades, S; Сегура, М; Сегура, М; Ками, J (2004). «Фармакология человека MDMA: фармакокинетика, метаболизм и расположение». Терапевтический мониторинг лекарственных средств . 26 (2): 137–144. DOI : 10.1097 / 00007691-200404000-00009 . PMID 15228154 .
- ^ EcstasyData.org. "EcstasyData.org: Статистика результатов тестов: вещества по годам" . www.ecstasydata.org . Проверено 27 июня 2017 года .
- ^ «Трансъевропейская информация о наркотиках» . idpc.net . Проверено 27 июня 2017 года .
- ^ Monte AP, Marona-Lewicka D, Коззи Н.В., Nichols DE (1993). «Синтез и фармакологическое исследование бензофурана, индана и тетралина аналогов 3,4- (метилендиокси) амфетамина». Журнал медицинской химии . 36 (23): 3700–3706. DOI : 10.1021 / jm00075a027 . PMID 8246240 .
- ^ a b c Бэгготт, MJ; Siegrist, JD; Galloway, GP; Робертсон, LC; Койл, младший; Мендельсон, Дж. Э. (2010). «Исследование механизмов индуцированных галлюциногенами видений с использованием 3,4-метилендиоксеамфетамина (MDA): рандомизированное контролируемое испытание на людях» . PLOS ONE . 5 (12): e14074. DOI : 10.1371 / journal.pone.0014074 . PMC 2996283 . PMID 21152030 .
- ^ а б Херндон, Джозеф М .; Холанцы, Арам Б .; Lau, Serrine S .; Монахи, Терренс Дж. (Март 2014 г.). «Ответ глиальных клеток на 3,4- (±) -метилендиоксиметамфетамин и его метаболиты» . Токсикологические науки . 138 (1): 130–138. DOI : 10.1093 / toxsci / kft275 . ISSN 1096-6080 . PMC 3930364 . PMID 24299738 .
- ^ Kalant, Гарольд (2 октября 2001). «Фармакология и токсикология« экстази »(МДМА) и родственных ему лекарств» . CMAJ: Журнал Канадской медицинской ассоциации . 165 (7): 917–928. ISSN 0820-3946 . PMC 81503 . PMID 11599334 .
- ^ Диас, Хайме. Как наркотики влияют на поведение. Энглвудские скалы: Прентис-холл, 1996.
- ^ Левин AH, Миллер М., Gilmour B (декабрь 2011). «Рецептор 1, связанный со следами аминов, представляет собой стереоселективный сайт связывания для соединений класса амфетаминов» . Биоорг. Med. Chem . 19 (23): 7044–8. DOI : 10.1016 / j.bmc.2011.10.007 . PMC 3236098 . PMID 22037049 .
- ^ Ротман RB, Baumann MH (2006). «Терапевтический потенциал субстратов переносчиков моноаминов» . Curr Top Med Chem . 6 (17): 1845–59. DOI : 10.2174 / 156802606778249766 . PMID 17017961 .
- ^ Джузеппе Ди Джованни; Винченцо Ди Маттео; Эннио Эспозито (2008). Взаимодействие серотонина и дофамина: экспериментальные данные и терапевтическая значимость . Эльзевир. С. 294–. ISBN 978-0-444-53235-0.
- ^ Ротман, Ричард Б; Бауманн, Майкл Х (2009). «Серотонинергические препараты и пороки сердца» . Экспертное заключение о безопасности лекарственных средств . 8 (3): 317–329. DOI : 10.1517 / 14740330902931524 . ISSN 1474-0338 . PMC 2695569 . PMID 19505264 .
- ^ Нэша ДФ, Рот Б.Л., Brodkin JD, Николс ДЕ, Gudelsky Г.А. (1994). «Влияние R (-) и S (+) изомеров MDA и MDMA на оборот фосфатидилинозита в культивируемых клетках, экспрессирующих рецепторы 5-HT2A или 5-HT2C». Neurosci. Lett . 177 (1–2): 111–5. DOI : 10.1016 / 0304-3940 (94) 90057-4 . PMID 7824160 . S2CID 41352480 .
- ^ Мансони, Оливье Жак; Рэй, Томас С. (2010). «Психоделики и рецептор человека» . PLOS ONE . 5 (2): e9019. DOI : 10.1371 / journal.pone.0009019 . ISSN 1932-6203 . PMC 2814854 . PMID 20126400 .
- ^ Muszynski, IE (1961). «Производство некоторых производных амфетамина». Acta Poloniae Pharmaceutica . 18 : 471–478. PMID 14477621 .
- ^ a b c Шульгин, Александр; Мэннинг, Таня; Дейли, Пол (2011). Индекс Шульгина, Том первый: психоделические фенэтиламины и родственные соединения (1-е изд.). Беркли, Калифорния: Transform Press. п. 165. ISBN 9780963009630.
- ^ Noggle, FT младший; DeRuiter, J .; Лонг, MJ. (1986). «Спектрофотометрическая и жидкостная хроматографическая идентификация 3,4-метилендиоксифенилизопропиламина и его гомологов N-метил и N-этил». Журнал Ассоциации официальных химиков-аналитиков . 69 (4): 681–686. PMID 2875058 .
- ^ a b Mannich, C .; Jacobsohn, W .; Манних, Hr. С. (1910). «Убер-оксифенил-алкиламин и диоксифенил-алкиламин» . Berichte der Deutschen Chemischen Gesellschaft . 41 (1): 189–197. DOI : 10.1002 / cber.19100430126 .
- ^ Хо, Бенг-Тонг; McIsaac, William M .; Ан, Ронг; Танси, Л. Уэйн; Уокер, Кеннет Э .; Энглерт младший, Лео Ф .; Ноэль, Майкл Б. (1970). «Аналоги а-метилфенэтиламина». Журнал медицинской химии . 13 (1): 26–30. DOI : 10.1021 / jm00295a007 . PMID 5412110 .
- ^ Баттерик, Джон Р .; Унрау, AM (1974). «Восстановление β-нитростирола с помощью дигидрида бис- (2-метоксиэтокси) -алюминия. Удобный путь к замещенным фенилизопропиламинам». Журнал химического общества, химические коммуникации . 8 (8): 307–308. DOI : 10.1039 / C39740000307 .
- ^ Тошитака, Охшита; Хироака, Андо (1992). «Синтез производных фенэтиламина как галлюциногена» . Японский журнал токсикологии и гигиены окружающей среды . 38 (6): 571–580. DOI : 10,1248 / jhs1956.38.571 . Проверено 20 июня 2014 года .
- ↑ Шульгин, Александр и Шульгин, Энн (1991). PiHKAL: химическая история любви . Лафайет, Калифорния: Transform Press. ISBN 9780963009609.
- ^ Elks, J .; Эй, Д.Х. (1943). «7. β-3: 4-Метилендиоксифенилизопропиламин». J. Chem. Soc . 0 : 15–16. DOI : 10.1039 / JR9430000015 . ISSN 0368-1769 .
- ^ Колбрих EA, Гудвин RS, Горелик Д.А., Hayes RJ, Stein EA, Huestis MA. Фармакокинетика плазмы 3,4-
метилендиоксиметамфетамина после контролируемого перорального введения молодым людям. Ther. Препарат Монит. 30: 320–332, 2008. - ^ Barnes AJ, Де Мартини Б. С., Горелик Д. Гудвин RS, Kolbrich Е.А., Huestis М.А. (2009). «Распределение МДМА и метаболитов в человеческом поту после контролируемого введения МДМА» . Клиническая химия . 55 (3): 454–62. DOI : 10,1373 / clinchem.2008.117093 . PMC 2669283 . PMID 19168553 .
- ^ Р. Базелт, Распоряжение токсичными лекарствами и химическими веществами у человека , 9-е издание, Биомедицинские публикации, Сил-Бич, Калифорния, 2011, стр. 1078–1080.
- ^ «Первая поездка MDA и измерение« мистического опыта »после MDA, LSD и Псилоцибина» . Психоделические исследования. 18 июля 2008. Архивировано из оригинала 13 июля 2012 года .
- ^ History Channel задокументировал подробности его смерти здесь https://www.youtube.com/watch?v=ySw-0uY4CUA См. Минуту 2:38 и далее.
- ^ Наранхо, C .; Шульгин АТ; Сарджент, Т. (1967). «Оценка 3,4-метилендиоксеамфетамина (МДА) в качестве дополнения к психотерапии». Фармакология . 17 (4): 359–364. DOI : 10.1159 / 000137100 . PMID 5631047 .
- ^ Yensen, R .; Ди Лео, FB; Rhead, JC; Ричардс, Вашингтон; Соскин Р.А.; Турек, Б .; Курляндия АА (1976). «Психотерапия с помощью MDA с невротическими пациентами в амбулаторных условиях: пилотное исследование». Журнал нервных и психических заболеваний . 163 (4): 233–245. DOI : 10.1097 / 00005053-197610000-00002 . PMID 972325 . S2CID 41155810 .
- ^ a b Стандарт ядов (октябрь 2015 г.) comlaw.gov.au
Внешние ссылки [ править ]
- Хранилище Erowid MDA
- Запись MDA в PiHKAL
- Запись MDA в PiHKAL • информация