Глюконеогенез ( ГНГ ) - это метаболический путь, который приводит к образованию глюкозы из определенных неуглеводных углеродных субстратов. Это повсеместный процесс, присутствующий у растений, животных, грибов, бактерий и других микроорганизмов. [1] В позвоночных, глюконеогенез происходит главным образом в печени и, в меньшей степени, в коре головного мозга из почек . Это один из двух основных механизмов - другой - разложение гликогена ( гликогенолиз ) - используемых людьми и многими другими животными для поддержания уровня глюкозы в крови , избегая низких уровней (гипогликемия ). [2] У жвачных животных , поскольку пищевые углеводы, как правило, метаболизируются организмами рубца , глюконеогенез происходит независимо от голодания, низкоуглеводной диеты, физических упражнений и т. Д. [3] У многих других животных процесс происходит во время голодания , голодания и т. низкоуглеводные диеты или интенсивные упражнения .
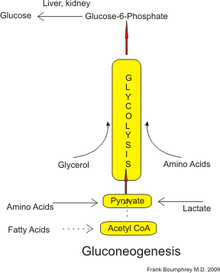
У людей субстраты для глюконеогенеза могут происходить из любых неуглеводных источников, которые могут быть преобразованы в пируват или промежуточные продукты гликолиза (см. Рисунок). Для расщепления белков эти субстраты включают глюкогенные аминокислоты (но не кетогенные аминокислоты ); в результате распада липидов (таких как триглицериды ) они включают глицерин , жирные кислоты с нечетной цепью (хотя и не жирные кислоты с четной цепью, см. ниже); и из других частей метаболизма они включают лактат из цикла Кори . В условиях длительного голодания ацетон получается изкетоновые тела также могут служить субстратом, обеспечивая путь от жирных кислот к глюкозе. [4] Хотя большая часть глюконеогенеза происходит в печени, относительный вклад глюконеогенеза почками увеличивается при диабете и длительном голодании. [5]
Путь глюконеогенеза в высшей степени эндергоничен, пока он не связан с гидролизом АТФ или ГТФ , что фактически делает процесс экзергоническим . Например, путь, ведущий от пирувата к глюкозо-6-фосфату, требует, чтобы 4 молекулы АТФ и 2 молекулы ГТФ продолжались спонтанно. Эти АТФ поступают в результате катаболизма жирных кислот через бета-окисление . [6]
Прекурсоры [ править ]
- Этой способностью обладают глюкогенные аминокислоты.
- Кетогенные аминокислоты этого не делают. Эти продукты все еще могут использоваться для кетогенеза или синтеза липидов .
- Некоторые аминокислоты катаболизируются как в глюкогенные, так и в кетогенные продукты.
В организме человека основными предшественниками глюконеогенных веществ являются лактат , глицерин (который является частью молекулы триацилглицерина ), аланин и глутамин . В общей сложности на них приходится более 90% общего глюконеогенеза. [8] Другие глюкогенные аминокислоты и все промежуточные продукты цикла лимонной кислоты (через превращение в оксалоацетат ) также могут функционировать как субстраты для глюконеогенеза. [9] Как правило, потребление человеком глюконеогенных субстратов с пищей не приводит к усилению глюконеогенеза. [10]
У жвачных животных пропионат является основным глюконеогенным субстратом. [3] [11] У нежвачных животных, включая людей, пропионат возникает в результате β-окисления жирных кислот с нечетной и разветвленной цепями, которые являются (относительно второстепенными) субстратом для глюконеогенеза. [12] [13]
Лактат транспортируется обратно в печень , где он преобразуется в пируват с помощью цикла Кори использованием фермента лактатдегидрогеназы . Затем для выработки глюкозы можно использовать пируват, первый назначенный субстрат глюконеогенного пути. [9] Трансаминирование или дезаминирование аминокислот облегчает включение их углеродного скелета в цикл напрямую (в виде пирувата или оксалоацетата) или косвенно через цикл лимонной кислоты. Вклад лактата цикла Кори в общее производство глюкозы увеличивается с увеличением продолжительности голодания . [14]В частности, после 12, 20 и 40 часов голодания добровольцев-людей вклад лактата цикла Кори в глюконеогенез составил 41%, 71% и 92% соответственно. [14]
Могут ли жирные кислоты с четной цепью превращаться в глюкозу у животных, это давний вопрос биохимии. [15] Жирные кислоты с нечетной цепью могут быть окислены с образованием ацетил-КоА и пропионил-КоА , последний служит предшественником сукцинил-КоА , который может превращаться в пируват и вступать в глюконеогенез. Напротив, жирные кислоты с четной цепью окисляются с образованием только ацетил-КоА, для вступления которого в глюконеогенез требуется наличие глиоксилатного цикла (также известного как глиоксилатный шунт) для производства четырехуглеродных предшественников дикарбоновой кислоты. [9]Глиоксилатный шунт состоит из двух ферментов, малатсинтазы и изоцитратлиазы, и присутствует в грибах, растениях и бактериях. Несмотря на некоторые сообщения о ферментативной активности глиоксилатного шунта, обнаруженной в тканях животных, гены, кодирующие обе ферментативные функции, были обнаружены только у нематод , у которых они существуют как один бифункциональный фермент. [16] [17] Гены, кодирующие только малатсинтазу (но не изоцитратлиазу), были идентифицированы у других многоклеточных животных, включая членистоногих , иглокожих и даже некоторых позвоночных . У млекопитающих, обладающих геном малатсинтазы, обнаружен монотрем ( утконос ) исумчатые ( опоссумы ), но не плацентарные млекопитающие . [17]
Существование глиоксилатного цикла у людей не было установлено, и широко распространено мнение, что жирные кислоты не могут быть напрямую преобразованы в глюкозу у людей. Было показано, что углерод-14 попадает в глюкозу, когда он поступает в жирные кислоты [18], но этого можно ожидать от включения меченых атомов, полученных из ацетил-КоА, в промежуточные соединения цикла лимонной кислоты, которые взаимозаменяемы с теми, которые получены из другие физиологические источники, такие как глюкогенные аминокислоты. [15] В отсутствие других глюкогенных источников, 2-углеродный ацетил-КоА, полученный в результате окисления жирных кислот, не может производить чистый выход глюкозы через цикл лимонной кислоты., поскольку эквивалентные два атома углерода выделяются в виде диоксида углерода во время цикла. Однако во время кетоза ацетил-КоА из жирных кислот дает кетоновые тела , включая ацетон , и до ~ 60% ацетона может окисляться в печени до предшественников пирувата - ацетола и метилглиоксаля . [19] [4] Таким образом, кетоновые тела, полученные из жирных кислот, могут составлять до 11% глюконеогенеза во время голодания. Катаболизм жирных кислот также производит энергию в форме АТФ, которая необходима для пути глюконеогенеза.
Местоположение [ править ]
Считается, что у млекопитающих глюконеогенез ограничен печенью [20] почками [20] кишечником [21] и мышцами [ необходима цитата ], но недавние данные указывают на то, что глюконеогенез происходит в астроцитах мозга. [22] Эти органы используют несколько разные глюконеогенные предшественники. Печень предпочтительно использует лактат, глицерин и глюкогенные аминокислоты (особенно аланин ), в то время как почки предпочтительно используют лактат, глутамин и глицерин. [23] [8] Лактат из цикла Корив количественном отношении является крупнейшим источником субстрата для глюконеогенеза, особенно для почек. [8] Печень использует и гликогенолиз, и глюконеогенез для производства глюкозы, тогда как почки задействуют только глюконеогенез. [8] После еды печень переключается на синтез гликогена , тогда как почки усиливают глюконеогенез. [10] Кишечник использует в основном глутамин и глицерин. [21]
Пропионат является основным субстратом для глюконеогенеза в печени жвачных животных, и печень жвачных может увеличить использование глюконеогенных аминокислот (например, аланина), когда потребность в глюкозе увеличивается. [24] Способность клеток печени использовать лактат для глюконеогенеза снижается от стадии до жвачного до стадии жвачного у телят и ягнят. [25] В ткани почек овцы наблюдалась очень высокая скорость глюконеогенеза пропионата. [26]
У всех видов образование оксалоацетата из пирувата и промежуточных продуктов цикла TCA ограничивается митохондрией, а ферменты, которые превращают фосфоенолпировиноградную кислоту (PEP) в глюкозо-6-фосфат, обнаруживаются в цитозоле. [27] Местоположение фермента, который связывает эти две части глюконеогенеза, превращая оксалоацетат в PEP - PEP-карбоксикиназу (PEPCK) - варьируется в зависимости от вида: он может находиться полностью в митохондриях , полностью в цитозоле или равномерно распределен между два, как и у людей. [27] Транспорт PEP через митохондриальную мембрану.осуществляется специальными транспортными белками; однако для оксалоацетата таких белков не существует . [27] Следовательно, у видов, у которых отсутствует внутримитохондриальный PEPCK, оксалоацетат должен быть преобразован в малат или аспартат , экспортирован из митохондрии и преобразован обратно в оксалоацетат , чтобы позволить продолжению глюконеогенеза. [27]
Путь [ править ]
Глюконеогенез - это путь, состоящий из серии из одиннадцати реакций, катализируемых ферментами. Путь начинается в печени или почках, в митохондриях или цитоплазме этих клеток, что зависит от используемого субстрата. Многие реакции являются обратными стадиям гликолиза .
- Глюконеогенез начинается в митохондриях с образования оксалоацетата путем карбоксилирования пирувата. Эта реакция также требует одной молекулы АТФ и катализируется пируваткарбоксилазой . Этот фермент стимулируется высокими уровнями ацетил-КоА (образуется в результате β-окисления в печени) и подавляется высокими уровнями АДФ и глюкозы.
- Оксалоацетат восстанавливается до малата с помощью НАДН , шага, необходимого для его транспортировки из митохондрий.
- Малат окисляется до оксалоацетата с помощью НАД + в цитозоле, где происходят оставшиеся этапы глюконеогенеза.
- Оксалоацетат декарбоксилируется, а затем фосфорилируется с образованием фосфоенолпирувата с использованием фермента PEPCK . В ходе этой реакции молекула GTP гидролизуется до GDP .
- Следующие шаги реакции такие же, как и при обратном гликолизе . Однако фруктозо-1,6-бисфосфатаза превращает фруктозо-1,6-бисфосфат в фруктозо-6-фосфат , используя одну молекулу воды и высвобождая один фосфат (при гликолизе фосфофруктокиназа 1 превращает F6P и ATP в F1,6BP и ADP ). Это также лимитирующая стадия глюконеогенеза.
- Глюкоза-6-фосфат образуется из фруктозо - 6-фосфата с помощью фосфоглюкоизомеразы (обратной стадия 2 в гликолизе). Глюкозо-6-фосфат можно использовать в других метаболических путях или дефосфорилировать до свободной глюкозы. В то время как свободная глюкоза может легко диффундировать в клетку и из клетки, фосфорилированная форма (глюкозо-6-фосфат) заблокирована в клетке - механизм, с помощью которого клетки контролируют внутриклеточные уровни глюкозы.
- Окончательный глюконеогенез, образование глюкозы происходит в просвете в эндоплазматической сети , где глюкоза-6-фосфат , гидролизованная глюкозо-6-фосфатазов для производства глюкозы и выпустить неорганический фосфат. Как и два предыдущих шага, этот шаг не является простым обращением гликолиза, при котором гексокиназа катализирует превращение глюкозы и АТФ в G6P и ADP. Глюкоза перемещается в цитоплазму переносчиками глюкозы, расположенными в мембране эндоплазматического ретикулума.
| Метаболизм обычных моносахаридов , включая гликолиз , глюконеогенез, гликогенез и гликогенолиз |
|---|
Регламент [ править ]
Хотя большинство стадий глюконеогенеза противоположны тем, которые обнаруживаются при гликолизе , три регулируемые и сильно эндергонические реакции заменяются более кинетически благоприятными реакциями. Ферменты гликолиза гексокиназа / глюкокиназа , фосфофруктокиназа и пируваткиназа заменяются глюкозо-6-фосфатазой , фруктозо-1,6-бисфосфатазой и PEP-карбоксиказой / пируваткарбоксилазой. Эти ферменты обычно регулируются подобными молекулами, но с противоположными результатами. Например, ацетил-КоА и цитратактивируют ферменты глюконеогенеза (пируваткарбоксилазу и фруктозо-1,6-бисфосфатаза соответственно), в то же время ингибируя гликолитический фермент пируваткиназу . Эта система взаимного контроля позволяет гликолизу и глюконеогенезу подавлять друг друга и предотвращает бесполезный цикл синтеза глюкозы, который только расщепляет ее. Пируваткиназу можно также обойти 86 путями [28], не связанными с глюконеогенезом, с целью образования пирувата, а затем и лактата; некоторые из этих путей используют атомы углерода, происходящие из глюкозы.
Большинство ферментов, ответственных за глюконеогенез, находится в цитозоле ; Исключение составляют митохондриальная пируваткарбоксилаза и фосфоенолпируваткарбоксилаза у животных . Последний существует как изофермент, расположенный как в митохондрии, так и в цитозоле . [29] Скорость глюконеогенеза в конечном итоге контролируется действием ключевого фермента, фруктозо-1,6-бисфосфатазы , которая также регулируется посредством передачи сигнала цАМФ и его фосфорилирования.
Глобальный контроль глюконеогенеза обеспечивается глюкагоном ( высвобождается при низком уровне глюкозы в крови ); он запускает фосфорилирование ферментов и регуляторных белков протеинкиназой А (киназой, регулируемой циклическим АМФ), что приводит к ингибированию гликолиза и стимуляции глюконеогенеза. Инсулин противодействует глюкагону, подавляя глюконеогенез. Диабет 2 типа характеризуется избытком глюкагона и инсулинорезистентностью организма. [30] Инсулин больше не может подавлять экспрессию генов ферментов, таких как PEPCK, что приводит к повышению уровня гипергликемии в организме. [31] Противодиабетический препарат метформин.снижает уровень глюкозы в крови в первую очередь за счет ингибирования глюконеогенеза, преодолевая неспособность инсулина ингибировать глюконеогенез из-за инсулинорезистентности. [32]
Исследования показали, что отсутствие продукции глюкозы печенью не оказывает большого влияния на контроль концентрации глюкозы в плазме натощак. Компенсаторная индукция глюконеогенеза происходит в почках и кишечнике под действием глюкагона , глюкокортикоидов и ацидоза. [33]
Инсулинорезистентность [ править ]
В печени белок FoxO6 FOX обычно способствует глюконеогенезу натощак, но инсулин блокирует Fox06 при кормлении. [34] В условиях инсулинорезистентности инсулин не может блокировать FoxO6, что приводит к продолжающемуся глюконеогенезу даже при кормлении, что приводит к высокому уровню глюкозы в крови ( гипергликемия ). [34]
Инсулинорезистентность - общая черта метаболического синдрома и диабета 2 типа . По этой причине глюконеогенез является мишенью терапии диабета 2 типа, такой как противодиабетический препарат метформин , который ингибирует образование глюконеогенной глюкозы и стимулирует поглощение глюкозы клетками. [35]
См. Также [ править ]
- Биоэнергетика
Ссылки [ править ]
- ^ Нельсон Д.Л., Кокс М. (2000). Принципы биохимии Ленингера . США: Worth Publishers. п. 724 . ISBN 978-1-57259-153-0.
- ^ Сильва П. "Химическая логика глюконеогенеза" . Архивировано из оригинального 26 августа 2009 года . Проверено 8 сентября 2009 года .
- ^ а б Бейтц, округ Колумбия (2004). «Углеводный обмен». В Риз WO (ред.). Герцогская физиология домашних животных (12-е изд.). Cornell Univ. Нажмите. С. 501–15.
- ^ a b Калета С., де Фигейредо Л. Ф., Вернер С., Гутке Р., Ристоу М., Шустер С. (июль 2011 г.). «In silico доказательства глюконеогенеза жирных кислот в организме человека» . PLOS Вычислительная биология . 7 (7): e1002116. Bibcode : 2011PLSCB ... 7E2116K . DOI : 10.1371 / journal.pcbi.1002116 . PMC 3140964 . PMID 21814506 .
- ^ Swe MT, Pongchaidecha A, Chatsudthipong V, Chattipakorn N, Lungkaphin A (июнь 2019). «Молекулярные сигнальные механизмы почечного глюконеогенеза в недиабетических и диабетических условиях». Журнал клеточной физиологии . 234 (6): 8134–8151. DOI : 10.1002 / jcp.27598 . PMID 30370538 .
- ^ Rodwell В (2015). Иллюстрированная биохимия Харпера, 30-е издание . США: Макгроу Хилл. п. 193. ISBN. 978-0-07-182537-5.
- ↑ Ferrier DR, Champe PC, Harvey RA (1 августа 2004 г.). «20. Разложение и синтез аминокислот». Биохимия (иллюстрированные обзоры Липпинкотта) . Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-2265-0.
- ^ a b c d Герих Дж. Э., Мейер С., Верле Г. Дж., Штумволл М. (февраль 2001 г.). «Почечный глюконеогенез: его значение в гомеостазе глюкозы человека» . Уход за диабетом . 24 (2): 382–91. DOI : 10.2337 / diacare.24.2.382 . PMID 11213896 .
- ^ a b c Гарретт Р. Х., Гришем К. М. (2002). Принципы биохимии с фокусом на человека . США: Брукс / Коул, Thomson Learning. стр. 578, 585. ISBN 978-0-03-097369-7.
- ^ a b Nuttall FQ, Ngo A, Gannon MC (сентябрь 2008 г.). "Регулирование производства глюкозы в печени и роль глюконеогенеза у человека: постоянна ли скорость глюконеогенеза?" . Исследования и обзоры диабета / метаболизма . 24 (6): 438–58. DOI : 10.1002 / dmrr.863 . PMID 18561209 . S2CID 24330397 .
- ^ Van Soest PJ (1994). Экология питания жвачных животных (2-е изд.). Cornell Univ. Нажмите. п. 476.
- ^ Rodwell VW, Бендеры Д.А., Botham К.М., Kennelly PJ, Weil PA (2018). Иллюстрированная биохимия Харпера (31-е изд.). Издательство McGraw-Hill.
- ^ Бейнс Дж, Dominiczak М (2014). Медицинская биохимия (4-е изд.). Эльзевир.
- ^ a b Кац Дж, Тайек Дж. А. (сентябрь 1998 г.). «Глюконеогенез и цикл Кори у людей, голодавших 12, 20 и 40 часов» . Американский журнал физиологии . 275 (3): E537-42. DOI : 10.1152 / ajpendo.1998.275.3.E537 . PMID 9725823 .
- ↑ a b de Figueiredo LF, Schuster S, Kaleta C, Fell DA (январь 2009 г.). «Может ли сахар быть произведен из жирных кислот? Тестовый пример для инструментов анализа пути» . Биоинформатика . 25 (1): 152–8. DOI : 10.1093 / биоинформатики / btn621 . PMID 19117076 .
- ^ Лю Ф, Тэтчер Дж. Д., Баррал Дж. М., Эпштейн Х. Ф. (июнь 1995 г.). «Бифункциональный белок глиоксилатного цикла Caenorhabditis elegans: белок кишечника и мышц, регулируемый развитием». Биология развития . 169 (2): 399–414. DOI : 10,1006 / dbio.1995.1156 . PMID 7781887 .
- ^ a b Кондрашов Ф.А., Кунин Е.В., Моргунов И.Г., Финогенова Т.В., Кондрашова М.Н. (октябрь 2006 г.). «Эволюция ферментов глиоксилатного цикла в Metazoa: свидетельство множественных событий горизонтального переноса и образования псевдогена» . Биология Директ . 1 : 31. DOI : 10.1186 / 1745-6150-1-31 . PMC 1630690 . PMID 17059607 .
- ^ Weinman EO, Strisower EH, Chaikoff IL (апрель 1957). «Превращение жирных кислот в углеводы; применение изотопов к этой проблеме и роль цикла Кребса как пути синтеза». Физиологические обзоры . 37 (2): 252–72. DOI : 10.1152 / Physrev.1957.37.2.252 . PMID 13441426 .
- ^ Рейхард Г.А., Хафф AC, Skutches CL, Paul P, Holroyde CP, Owen OE (апрель 1979). «Метаболизм ацетона в плазме натощак» . Журнал клинических исследований . 63 (4): 619–26. DOI : 10.1172 / JCI109344 . PMC 371996 . PMID 438326 .
- ^ a b Видмайер E (2006). Физиология человека Вандера . Макгроу Хилл. п. 96 . ISBN 978-0-07-282741-5.
- ^ a b Mithieux G, Rajas F, Gautier-Stein A (октябрь 2004 г.). «Новая роль глюкозо-6-фосфатазы в тонком кишечнике в контроле гомеостаза глюкозы» . Журнал биологической химии . 279 (43): 44231–4. DOI : 10.1074 / jbc.R400011200 . PMID 15302872 .
- Перейти ↑ Yip J, Geng X, Shen J, Ding Y (2017). «Церебральный глюконеогенез и заболевания» . Границы фармакологии . 7 : 521. DOI : 10.3389 / fphar.2016.00521 . PMC 5209353 . PMID 28101056 .
- ^ Герих JE (февраль 2010 г.). «Роль почек в нормальном гомеостазе глюкозы и гипергликемии сахарного диабета: терапевтические последствия» . Диабетическая медицина . 27 (2): 136–42. DOI : 10.1111 / j.1464-5491.2009.02894.x . PMC 4232006 . PMID 20546255 .
- ^ Овертон TR, Drackley JK, Ottemann-Abbamonte CJ, Beaulieu А.Д., Эммерт Л.С., Кларк JH (июль 1999). «Использование субстрата для глюконеогенеза в печени изменяется из-за повышенной потребности в глюкозе у жвачных животных». Журнал зоотехники . 77 (7): 1940–51. DOI : 10.2527 / 1999.7771940x . PMID 10438042 .
- ^ Donkin SS, Арменанто LE (февраль 1995). «Регулирование глюконеогенеза инсулином и глюкагоном у коров до жвачки и жвачки». Журнал зоотехники . 73 (2): 546–51. DOI : 10.2527 / 1995.732546x . PMID 7601789 .
- ^ Donkin SS, Арменанто LE (февраль 1995). «Регулирование глюконеогенеза инсулином и глюкагоном у коров до жвачки и жвачки». Журнал зоотехники . 73 (2): 546–51. DOI : 10.2527 / 1995.732546x . PMID 7601789 .
- ^ a b c d Voet D, Voet J, Pratt C (2008). Основы биохимии . John Wiley & Sons Inc. стр. 556 . ISBN 978-0-470-12930-2.
- ^ Христос Чинопулос (2020), От глюкозы до лактата и транзита промежуточных продуктов через митохондрии, обход пируваткиназы: соображения для клеток, демонстрирующих димерную PKM2 или иным образом ингибируемую активность киназы, https://www.frontiersin.org/articles/10.3389/fphys.2020.5435 /полный
- ^ Чакраварти К, Кассуто Н, Решеф л, Hanson RW (2005). «Факторы, контролирующие тканеспецифическую транскрипцию гена фосфоенолпируваткарбоксикиназы-C». Критические обзоры в биохимии и молекулярной биологии . 40 (3): 129–54. DOI : 10.1080 / 10409230590935479 . PMID 15917397 . S2CID 633399 .
- ^ Он L, Sabet A, S Djedjos Миллер R, вс X, Хуссейн М. А. и др. (Май 2009 г.). «Метформин и инсулин подавляют глюконеогенез в печени путем фосфорилирования связывающего белка CREB» . Cell . 137 (4): 635–46. DOI : 10.1016 / j.cell.2009.03.016 . PMC 2775562 . PMID 19450513 .
- ^ Hatting M, Таварес CD, Sharabi K, Rines А.К., Puigserver P (январь 2018). «Инсулиновая регуляция глюконеогенеза» . Летопись Нью-Йоркской академии наук . 1411 (1): 21–35. Bibcode : 2018NYASA1411 ... 21H . DOI : 10.1111 / nyas.13435 . PMC 5927596 . PMID 28868790 .
- ^ Ван И, Тан Х, Цзи Х, Чжан И, Сюй В, Ян Х и др. (Январь 2018). «Анализ профиля экспрессии длинных некодирующих РНК, вовлеченных в ингибируемый метформином глюконеогенез первичных гепатоцитов мыши» . Международный журнал молекулярной медицины . 41 (1): 302–310. DOI : 10.3892 / ijmm.2017.3243 . PMC 5746302 . PMID 29115403 .
- ^ Mutel Е, Готье-Штейн А, Абдул-Wahed А, Amigo-Correig М, Zitoun С, Stefanutti А, и др. (Декабрь 2011 г.). «Контроль уровня глюкозы в крови при отсутствии продукции глюкозы в печени во время длительного голодания у мышей: индукция глюкагоном почечного и кишечного глюконеогенеза» . Диабет . 60 (12): 3121–31. DOI : 10,2337 / db11-0571 . PMC 3219939 . PMID 22013018 .
- ↑ a b Lee S, Dong HH (май 2017 г.). «FoxO интеграция передачи сигналов инсулина с метаболизмом глюкозы и липидов» . Журнал эндокринологии . 233 (2): R67 – R79. DOI : 10.1530 / JOE-17-0002 . PMC 5480241 . PMID 28213398 .
- ^ Hundal RS, Krssak M, Dufour S, Laurent D, Lebon V, Chandramouli V и др. (Декабрь 2000 г.). «Механизм, с помощью которого метформин снижает выработку глюкозы при диабете 2 типа» . Диабет . 49 (12): 2063–9. DOI : 10.2337 / diabetes.49.12.2063 . PMC 2995498 . PMID 11118008 . «Бесплатный полный текст» . (82 КБ )
Внешние ссылки [ править ]
- Обзор на indstate.edu
- Интерактивная диаграмма на uakron.edu
- Химическая логика глюконеогенеза
- metpath : интерактивное представление глюконеогенеза