| Часть серии по |
| Генная инженерия |
|---|
 |
| Генетически модифицированные организмы |
| История и регулирование |
| Процесс |
| Приложения |
| Споры |
Генная терапия - это область медицины, которая фокусируется на генетической модификации клеток для достижения терапевтического эффекта [1] или лечении заболеваний путем восстановления или реконструкции дефектного генетического материала. [2] Первая попытка модификации человеческой ДНК была предпринята в 1980 году Мартином Клайном , но первая успешная передача ядерного гена человеку, одобренная Национальным институтом здравоохранения , была проведена в мае 1989 года. [3] Первое терапевтическое использование Перенос генов, а также первое прямое введение ДНК человека в ядерный геном был выполнен Френчем Андерсоном.в испытаниях, начавшихся в сентябре 1990 года. Считается, что с его помощью можно вылечить многие генетические нарушения или вылечить их с течением времени.
В период с 1989 по декабрь 2018 года, было проведено более 2900 клинических испытаний, причем более половины из них в фазе I . [4] По состоянию на 2017 год, Spark Therapeutics ' Luxturna ( слепота, вызванная мутацией RPE65 ) и Novartis' Kymriah ( Т-клеточная терапия химерного антигенного рецептора ) являются первыми одобренными FDA генными препаратами, которые вышли на рынок. С тех пор такие препараты , как Zolgensma от Novartis и Patisiran от Alnylam , также получили одобрение FDA в дополнение к препаратам для генной терапии других компаний. В большинстве этих подходов используются аденоассоциированные вирусы (AAV) илентивирусы для выполнения вставок генов in vivo и ex vivo соответственно. Подходы ASO / siRNA, такие как применяемые Alnylam и Ionis Pharmaceuticals, требуют невирусных систем доставки и используют альтернативные механизмы доставки в клетки печени посредством транспортеров GalNAc .
Концепция генной терапии заключается в устранении генетической проблемы в ее источнике. Если, например, при наследственном заболевании (обычно рецессивном) мутация в определенном гене приводит к выработке дисфункционального белка, можно использовать генную терапию для доставки копии этого гена, не содержащей вредной мутации, и тем самым производит функциональный белок. Эта стратегия называется генной заместительной терапией и применяется для лечения наследственных заболеваний сетчатки. [5] [6]
Хотя концепция генной заместительной терапии в основном подходит для рецессивных заболеваний, были предложены новые стратегии, которые также способны лечить состояния с доминантным типом наследования.
- Введение редактирования генов CRISPR открыло новые возможности для его применения и использования в генной терапии, поскольку вместо чистой замены гена оно позволяет исправить конкретный генетический дефект. [7] Решения медицинских препятствий, такие как искоренение латентных резервуаров вируса иммунодефицита человека ( ВИЧ ) и исправление мутации, вызывающей серповидно-клеточную анемию, могут быть доступны в качестве терапевтического варианта в будущем. [8] [9] [10]
- Протезная генная терапия направлена на то, чтобы позволить клеткам тела взять на себя функции, которые они физиологически не выполняют. Одним из примеров является так называемая генная терапия восстановления зрения, которая направлена на восстановление зрения у пациентов, страдающих терминальными заболеваниями сетчатки. [11] [12] При терминальной стадии заболеваний сетчатки фоторецепторы как первичные светочувствительные клетки сетчатки безвозвратно теряются. Посредством протезной генной терапии светочувствительные белки доставляются в оставшиеся клетки сетчатки, чтобы сделать их светочувствительными и тем самым дать им возможность передавать визуальную информацию в мозг. Клинические испытания продолжаются. ( NCT02556736 , NCT03326336 в clinicaltrials.gov )
Не все медицинские процедуры, которые вносят изменения в генетический состав пациента, можно считать генной терапией. Было обнаружено, что трансплантация костного мозга и трансплантация органов в целом вводят в организм пациентов чужеродную ДНК. [13] Генная терапия определяется точностью процедуры и намерением получить прямой терапевтический эффект.
Фон [ править ]
Генная терапия была концептуализирована в 1972 году авторами, которые призвали с осторожностью начинать исследования генной терапии на людях.
Первая, неудачная попытка генной терапии (а также первый случай медицинской передачи чужеродных генов человеку, не считая трансплантации органов ) была предпринята Мартином Клайном 10 июля 1980 года. [14] [15] Клайн утверждал, что один из генов у его пациентов был активен шесть месяцев спустя, хотя он никогда не публиковал эти данные и не проверял их [16], и даже если он прав, маловероятно, что он произвел какие-либо значительные положительные эффекты при лечении бета-талассемии . [ требуется медицинская цитата ]
После обширных исследований на животное на протяжении 1980 - х и мечения проб 1989 бактериального гена на людях, первая генную терапия широкого признания как успех был продемонстрирован в суде , который начался 14 сентября 1990 года, когда Аша DeSilva лечился ADA - SCID . [17]
Первое соматическое лечение, которое привело к необратимым генетическим изменениям, было начато в 1993 году. Цель состояла в том, чтобы вылечить злокачественные опухоли мозга с помощью рекомбинантной ДНК для передачи гена, делающего опухолевые клетки чувствительными к лекарству, которое, в свою очередь, заставляло опухолевые клетки умирать. [18]
Полимеры либо транслируются в белки , либо препятствуют экспрессии целевого гена , либо, возможно, исправляют генетические мутации . В наиболее распространенной форме используется ДНК, которая кодирует функциональный терапевтический ген для замены мутировавшего гена. Молекула полимера упакована в « вектор », который несет молекулу внутри клетки. [ требуется медицинская цитата ]
Ранние клинические неудачи привели к отказу от генной терапии. Клинические успехи с 2006 года вновь привлекли внимание исследователей, хотя по состоянию на 2014 год [Обновить]это все еще оставалось в основном экспериментальным методом. [19] Они включают лечение заболеваний сетчатки , врожденного амавроза Лебера [5] [20] [21] [22] и хоридеремии , [23] X-сцепленного SCID , [24] ADA-SCID, [25] [26] адренолейкодистрофии , [27] хронический лимфолейкоз (ХЛЛ), [28] острый лимфолейкоз (ОЛЛ), [29] множественная миелома., [30] гемофилия , [26] и болезнь Паркинсона . [31] В период с 2013 по апрель 2014 года американские компании инвестировали в эту область более 600 миллионов долларов. [32]
Первая коммерческая генная терапия, Гендицина , была одобрена в Китае в 2003 году для лечения некоторых видов рака. [33] В 2011 году Неоваскулген был зарегистрирован в России как первый в своем классе генно-терапевтический препарат для лечения заболеваний периферических артерий , в том числе критической ишемии конечностей . [34] В 2012 году Glybera , средство для лечения редкого наследственного заболевания , дефицита липопротеинлипазы, стала первым препаратом, одобренным для клинического использования в Европе или США после его одобрения Европейской комиссией . [19] [35]
Следуя ранним достижениям в области генной инженерии бактерий, клеток и мелких животных, ученые начали думать о том, как применить это в медицине. Были рассмотрены два основных подхода - замена или разрушение дефектных генов. [36] Ученые сосредоточили свое внимание на заболеваниях, вызванных дефектами одного гена, таких как муковисцидоз , гемофилия , мышечная дистрофия , талассемия и серповидно-клеточная анемия . Глибера лечит одно из таких заболеваний, вызванное дефектом липопротеинлипазы . [35]
ДНК необходимо вводить, достигать поврежденных клеток, проникать в клетку и либо экспрессировать, либо разрушать белок. [37] Были изучены множественные методы доставки. Первоначальный подход включал ДНК в созданный вирус для доставки ДНК в хромосому . [38] [39] Подходы « голой ДНК» также изучались, особенно в контексте разработки вакцин . [40]
Как правило, усилия сосредоточены на введении гена, который вызывает экспрессию необходимого белка. Совсем недавно более глубокое понимание функции нуклеаз привело к более прямому редактированию ДНК с использованием таких методов, как нуклеазы цинкового пальца и CRISPR . Вектор включает гены в хромосомы. Затем экспрессированные нуклеазы нокаутируют и заменяют гены в хромосоме. По состоянию на 2014 год [Обновить]эти подходы включают удаление клеток у пациентов, редактирование хромосом и возвращение трансформированных клеток пациентам. [41]
Редактирование генов - это потенциальный подход к изменению генома человека для лечения генетических заболеваний [7], вирусных заболеваний [42] и рака. [43] [44] С 2020 года [Обновить]эти подходы изучаются в клинических испытаниях. [45] [46]
Типы ячеек [ править ]
Генную терапию можно разделить на два типа:
Соматический [ править ]
При генной терапии соматических клеток (SCGT) терапевтические гены переносятся в любую клетку, кроме гамет , зародышевых клеток , гаметоцитов или недифференцированных стволовых клеток . Любые такие изменения влияют на отдельный пациенте только, и не наследуются потомством . Соматическая генная терапия представляет собой основное направление фундаментальных и клинических исследований, в которых терапевтическая ДНК (либо интегрированная в геном, либо как внешняя эписома или плазмида ) используется для лечения заболевания. [47]
В настоящее время проводится более 600 клинических испытаний SCGT [ когда? ] в США. Большинство из них сосредоточены на тяжелых генетических нарушениях, включая иммунодефицит , гемофилию , талассемию и муковисцидоз . Такие единичные генные расстройства являются хорошими кандидатами для терапии соматическими клетками. Полная коррекция генетического нарушения или замена нескольких генов пока невозможны. Лишь некоторые испытания находятся на продвинутой стадии. [48] [ требуется обновление ]
Зародышевый слой [ править ]
В генной терапии зародышевой линии (GGT) половые клетки ( сперматозоиды или яйцеклетки ) модифицируются путем введения функциональных генов в их геномы. Изменение зародышевой клетки приводит к тому, что все клетки организма содержат модифицированный ген. Таким образом, изменение передается по наследству и передается последующим поколениям. Австралия, Канада, Германия, Израиль, Швейцария и Нидерланды [49] запрещают применение GGT у людей по техническим и этическим причинам, включая недостаточные знания о возможных рисках для будущих поколений [49] и более высокие риски по сравнению с SCGT. [50] В США нет федерального контроля, конкретно касающегося генетической модификации человека (помимо правил FDA для лечения в целом). [49] [51] [52] [53]
Векторы [ править ]
Доставка ДНК в клетки может осуществляться несколькими способами . Двумя основными классами являются рекомбинантные вирусы (иногда называемые биологическими наночастицами или вирусными векторами) и голая ДНК или комплексы ДНК (невирусные методы). [ требуется медицинская цитата ]
Вирусы [ править ]
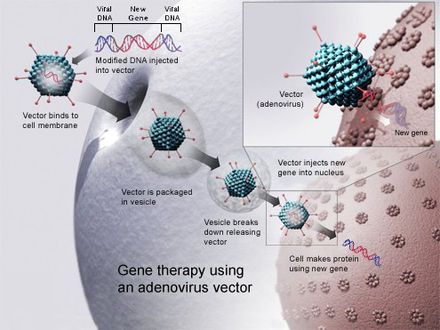
Для того , чтобы реплицировать , вирусы ввести свой генетический материал в клетку - хозяина, обманывая клеточные механизмы хозяина в использовании его в качестве чертежей для вирусных белков. Ретровирусы идут еще дальше, копируя свой генетический материал в геном клетки-хозяина. Ученые используют это, заменяя генетический материал вируса терапевтической ДНК. (Термин «ДНК» может быть чрезмерным упрощением, поскольку некоторые вирусы содержат РНК, и генная терапия также может принимать эту форму.) Для генной терапии человека использовался ряд вирусов, в том числе ретровирусы , аденовирусы , простой герпес , коровья оспа и др. и аденоассоциированный вирус. [4] Подобно генетическому материалу (ДНК или РНК) в вирусах, терапевтическая ДНК может быть разработана так, чтобы просто служить временным планом, который разрушается естественным путем или (по крайней мере теоретически) для проникновения в геном хозяина, становясь постоянной частью его ДНК в инфицированных клетках.
Невирусное [ править ]
Этот раздел требует дополнительных ссылок для проверки . ( Апрель 2021 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
Невирусные методы обладают определенными преимуществами перед вирусными методами, такими как крупномасштабное производство и низкая иммуногенность хозяина . Однако невирусные методы первоначально приводили к более низким уровням трансфекции и экспрессии генов и, следовательно, к более низкой терапевтической эффективности. Новые технологии обещают решить эти проблемы с появлением усиленного нацеливания на клетки и контроля субклеточного трафика.
Способы невирусной генной терапии включают инъекцию «голой» ДНК, электропорацию , генную пушку , сонопорацию , магнитофекцию , использование олигонуклеотидов , липоплексов, дендримеров и неорганических наночастиц.
Более поздние подходы, такие как те, которые выполняются такими компаниями, как Ligandal , предлагают возможность создания клеточно-специфических технологий нацеливания для различных методов генной терапии, включая РНК, ДНК и инструменты редактирования генов, такие как CRISPR. Другие компании, такие как Arbutus Biopharma и Arcturus Therapeutics , предлагают невирусные, неклеточные подходы, которые в основном проявляют трофику печени. В последние годы такие стартапы, как Sixfold Bio , GenEdit и Spotlight Therapeuticsначали решать проблему доставки невирусных генов. Невирусные методы предлагают возможность повторного дозирования и большую адаптацию генетических полезных нагрузок, которые в будущем с большей вероятностью возьмут на себя системы доставки на основе вирусов.
Такие компании, как Editas Medicine , Intellia Therapeutics , CRISPR Therapeutics , Casebia , Cellectis , Precision Biosciences , bluebird bio и Sangamo , разработали невирусные методы редактирования генов, однако часто до сих пор используют вирусы для доставки материала для вставки генов после геномного расщепления управляемыми нуклеазами . Эти компании сосредоточены на редактировании генов, но по-прежнему сталкиваются с серьезными проблемами.
BioNTech , Moderna Therapeutics и CureVac сосредотачиваются на доставке полезных нагрузок мРНК , которые обязательно являются невирусными проблемами доставки.
Alnylam , Dicerna Pharmaceuticals и Ionis Pharmaceuticals фокусируются на доставке миРНК (антисмысловые олигонуклеотиды) для подавления генов, что также требует невирусных систем доставки.
В академическом контексте ряд лабораторий работает над доставкой ПЭГилированных частиц, которые образуют короны сывороточного белка и в основном демонстрируют опосредованное рецептором ЛПНП поглощение клетками in vivo . [54]
Возможное медицинское использование [ править ]
Предполагаемое использование генной терапии включает:
Генный допинг [ править ]
Спортсмены могут применять технологии генной терапии для улучшения своих результатов. [55] Генный допинг не известен, но такие эффекты могут иметь множественные генные терапии. Kayser et al. утверждают, что генный допинг может уравнять правила игры, если все спортсмены получат равный доступ. Критики утверждают, что любое терапевтическое вмешательство в целях, не связанных с лечением или улучшением здоровья, ставит под угрозу этические основы медицины и спорта. [56]
Генная инженерия человека [ править ]
Генная инженерия может использоваться для лечения болезней, а также для изменения внешнего вида, метаболизма и даже улучшения физических возможностей и умственных способностей, таких как память и интеллект . Этические утверждения о зародышевой инженерии включают убеждение, что каждый плод имеет право оставаться генетически немодифицированным, что родители имеют право генетически модифицировать свое потомство и что каждый ребенок имеет право родиться без болезней, которые можно предотвратить. [57] [58] [59] Для родителей генная инженерия может рассматриваться как еще один метод улучшения ребенка, который можно добавить к диете, упражнениям, образованию, тренировкам, косметике и пластической хирургии. [60][61] Другой теоретик утверждает, что моральные соображения ограничивают, но не запрещают инженерию зародышевой линии. [62]
Недавний выпуск журнала Bioethics был посвящен моральным вопросам, связанным с генной инженерией зародышевой линии у людей. [63]
Возможные схемы регулирования включают полный запрет, предоставление всем или профессиональное саморегулирование. Совет Американской медицинской ассоциации по этическим и судебным вопросам заявил, что «генетические вмешательства для улучшения характеристик должны считаться допустимыми только в строго ограниченных ситуациях: (1) явная и значимая польза для плода или ребенка; (2) отсутствие компромиссов с другими характеристиками или чертами и (3) равный доступ к генетической технологии, независимо от дохода или других социально-экономических характеристик ". [64]
Еще в начале истории биотехнологии, в 1990 году, были ученые, выступавшие против попыток изменить зародышевую линию человека с помощью этих новых инструментов [65], и такие опасения сохранялись по мере развития технологий. [66] [67] С появлением новых методов, таких как CRISPR , в марте 2015 года группа ученых призвала к введению во всем мире моратория на клиническое использование технологий редактирования генов для редактирования генома человека таким образом, чтобы его можно было унаследовать. [68] [69] [70] [71] В апреле 2015 года исследователи вызвали споры, когда они сообщили о результатах фундаментальных исследований по редактированиюДНК нежизнеспособных человеческих эмбрионов с использованием CRISPR. [72] [73] Комитет Американской национальной академии наук и Национальной медицинской академии оказал квалифицированную поддержку редактированию генома человека в 2017 году [74] [75] после того, как были найдены ответы на проблемы безопасности и эффективности, «но только для серьезных условия под строгим контролем ». [76]
Лечение генетических заболеваний [ править ]
Были предложены подходы генной терапии для замены дефектного гена здоровым геном, и они изучаются для лечения некоторых генетических заболеваний. Заболевания, такие как серповидноклеточная анемия , вызванные аутосомно-рецессивными заболеваниями, при которых нормальный фенотип человека или функция клеток могут быть восстановлены в клетках, пораженных заболеванием, с помощью нормальной копии мутировавшего гена, могут быть хорошим кандидатом для генной терапии. лечение. [77] Риски и преимущества, связанные с генной терапией серповидноклеточной анемии , неизвестны. [77]
Побочные эффекты, противопоказания и препятствия для использования [ править ]
Некоторые из нерешенных проблем включают:
- Недолговечность - прежде чем генная терапия сможет стать постоянным лекарством от состояния, терапевтическая ДНК, введенная в клетки-мишени, должна оставаться функциональной, а клетки, содержащие терапевтическую ДНК, должны быть стабильными. Проблемы с интеграцией терапевтической ДНК в геном и быстро делящаяся природа многих клеток не позволяют добиться долгосрочных преимуществ. Пациентам требуется несколько процедур.
- Иммунный ответ - каждый раз, когда инородный объект попадает в ткани человека, иммунная система стимулируется атаковать захватчика. Возможна стимуляция иммунной системы, снижающая эффективность генной терапии. Иммунная система «ы усиливается реакция на вирусы , которые он видел раньше снижает эффективность до повторных обработок.
- Проблемы с вирусными векторами. Вирусные векторы несут в себе риски токсичности, воспалительных реакций и проблем с контролем генов и их нацеливанием.
- Мультигенные расстройства. На некоторые часто встречающиеся расстройства, такие как болезни сердца , высокое кровяное давление , болезнь Альцгеймера , артрит и диабет , влияют вариации нескольких генов, которые усложняют генную терапию.
- Некоторые методы лечения могут нарушить барьер Вейсмана (между сомой и зародышевой линией), защищающий семенники, потенциально изменяя зародышевую линию, нарушая правила в странах, которые запрещают последнюю практику. [78]
- Инсерционный мутагенез - если ДНК интегрирована в чувствительное место в геноме, например, в ген-супрессор опухоли , терапия может вызвать опухоль . Это произошло в клинических испытаниях пациентов с Х-сцепленным тяжелым комбинированным иммунодефицитом (X-SCID), у которых гемопоэтические стволовые клетки были трансдуцированы корректирующим трансгеном с использованием ретровируса , и это привело к развитию Т-клеточного лейкоза у 3 из 20 пациентов. . [79] [80]Одним из возможных решений является добавление функционального гена-супрессора опухоли к ДНК, которую необходимо интегрировать. Это может быть проблематично, поскольку чем длиннее ДНК, тем труднее интегрироваться в геномы клеток. [81] Технология CRISPR позволяет исследователям вносить гораздо более точные изменения генома в точных местах. [82]
- Стоимость - например, Алипоген типарвовек или Глибера стоимостью 1,6 миллиона долларов на пациента в 2013 году, как сообщалось, был самым дорогим лекарством в мире. [83] [84]
Смерти [ править ]
В ходе испытаний генной терапии было зарегистрировано три случая смерти пациентов, что поставило эту область под пристальное внимание. Первым был Джесси Гелсинджер , который умер в 1999 году из-за реакции иммунного отторжения. [85] [86] Один пациент с X-SCID умер от лейкемии в 2003 году. [17] В 2007 году пациент с ревматоидным артритом умер от инфекции; последующее расследование пришло к выводу, что смерть не была связана с генной терапией. [87]
Правила [ править ]
Правила, регулирующие генетическую модификацию, являются частью общих руководящих принципов биомедицинских исследований с участием человека. В этой области нет международных договоров, имеющих обязательную юридическую силу, но есть рекомендации по национальному законодательству от различных органов.
В Хельсинкскую декларацию (Этические принципы медицинских исследований с участием людей) в 2008 г. были внесены поправки на Генеральной ассамблее Всемирной медицинской ассоциации . В этом документе изложены принципы, которые врачи и исследователи должны учитывать при привлечении людей в качестве объектов исследования. Заявление об исследованиях генной терапии, инициированное Организацией генома человека (HUGO) в 2001 году, обеспечивает юридическую основу для всех стран. В документе HUGO подчеркивается свобода человека и соблюдение прав человека, а также предлагаются рекомендации по соматической генной терапии, включая важность признания обеспокоенности общественности по поводу таких исследований. [88]
Соединенные Штаты [ править ]
Ни одно федеральное законодательство не устанавливает протоколов или ограничений в отношении генной инженерии человека. Этот вопрос регулируется частично совпадающими правилами местных и федеральных агентств, включая Министерство здравоохранения и социальных служб , FDA и Консультативный комитет по рекомбинантной ДНК NIH. Исследователи, которым нужны федеральные средства для исследования нового лекарственного препарата (как правило, в случае соматической генной инженерии человека), должны подчиняться международным и федеральным руководящим принципам по защите людей. [89]
NIH служит основным регулятором генной терапии для исследований, финансируемых из федерального бюджета. Рекомендуется соблюдать эти правила при проведении исследований, финансируемых из частных источников. NIH предоставляет финансирование для исследований, которые развивают или совершенствуют методы генной инженерии, а также для оценки этичности и качества текущих исследований. NIH ведет обязательный реестр протоколов исследований генной инженерии человека, который включает все проекты, финансируемые из федерального бюджета.
Консультативный комитет NIH опубликовал набор руководящих принципов по манипулированию генами. [90] В руководстве обсуждаются вопросы безопасности лабораторий, а также испытуемых на людях и различных экспериментальных типов, которые связаны с генетическими изменениями. Несколько разделов конкретно относятся к генной инженерии человека, включая Раздел III-C-1. В этом разделе описаны необходимые процессы проверки и другие аспекты при поиске разрешения на начало клинических исследований, связанных с генетической передачей пациенту-человеку. [91] Протокол клинического испытания генной терапии должен быть одобрен Консультативным комитетом по рекомбинантной ДНК Национального института здоровья до начала любого клинического испытания; это отличается от любого другого клинического исследования. [90]
Как и в случае с другими видами лекарств, FDA регулирует качество и безопасность продуктов генной терапии и контролирует, как эти продукты используются в клинической практике. Терапевтическое изменение генома человека подпадает под те же нормативные требования, что и любое другое лечение. Исследования с участием людей в качестве субъектов, такие как клинические испытания , должны быть рассмотрены и одобрены FDA и институциональным наблюдательным советом . [92] [93]
История [ править ]
Этот раздел может быть слишком длинным и излишне подробным. ( Ноябрь 2018 г. ) |
1970-е годы и ранее [ править ]
В 1972 году Фридман и Роблин опубликовали в журнале Science статью под названием «Генная терапия генетических заболеваний человека?» [94] Роджерс (1970) был процитирован за предложение использовать экзогенную хорошую ДНК для замены дефектной ДНК у тех, кто страдает от генетических дефектов. [95]
1980-е [ править ]
В 1984 году была разработана ретровирусная векторная система, которая могла эффективно вставлять чужеродные гены в хромосомы млекопитающих. [96]
1990-е [ править ]
Первое утвержденное клиническое исследование генной терапии в США было проведено 14 сентября 1990 года в Национальном институте здравоохранения (NIH) под руководством Уильяма Френча Андерсона . [97] Четырехлетняя Ашанти ДеСильва прошла курс лечения от генетического дефекта, в результате которого у нее осталась АДА - ТКИД., серьезный дефицит иммунной системы. Дефектный ген клеток крови пациента заменен функциональным вариантом. Иммунная система Ашанти была частично восстановлена терапией. Производство отсутствующего фермента было временно стимулировано, но новые клетки с функциональными генами не были созданы. Она вела нормальную жизнь только с регулярными инъекциями каждые два месяца. Эффект был успешным, но временным. [98]
Генная терапия рака была введена в 1992/93 году (Trojan et al. 1993). [99] Лечение мультиформной глиобластомы, злокачественной опухоли головного мозга, исход которой всегда фатален, проводилось с использованием вектора, экспрессирующего антисмысловую РНК IGF-I (клиническое испытание одобрено протоколом NIH № 1602 24 ноября 1993 г. [100] и FDA в 1994 г.). Эта терапия также представляет собой начало иммуногенной терапии рака, лечения, которое оказывается эффективным благодаря противоопухолевому механизму антисмысловой активности IGF-I, который связан с сильными иммунными и апоптотическими явлениями.
В 1992 году Клаудио Бординьон , работающий в университете Вита-Салюте Сан-Рафаэле , выполнил первую процедуру генной терапии с использованием гемопоэтических стволовых клеток в качестве векторов для доставки генов, предназначенных для коррекции наследственных заболеваний . [101] В 2002 году эта работа привела к публикации первого успешного метода генной терапии для лечения дефицита аденозиндезаминазы (ADA-SCID). Успех многоцентрового исследования по лечению детей с ТКИД ( тяжелый комбинированный иммунодефицитили болезнь «пузырящегося мальчика») с 2000 по 2002 год, был задан вопрос, когда у двоих из десяти детей, проходивших лечение в парижском центре испытаний, развилось состояние, подобное лейкемии. Клинические испытания были временно приостановлены в 2002 году, но возобновлены после нормативного пересмотра протокола в США, Великобритании, Франции, Италии и Германии. [102]
В 1993 году Эндрю Гобеа родился с ТКИН после пренатального генетического скрининга . Кровь была удалена из плаценты и пуповины его матери сразу после рождения для получения стволовых клеток. Аллель , который кодирует аденозиндезаминазы (ADA) был получен и вставляется в ретровируса. Ретровирусы и стволовые клетки были смешаны, после чего вирусы вставили ген в хромосомы стволовых клеток. Стволовые клетки, содержащие рабочий ген ADA, вводили в кровь Эндрю. Инъекции фермента ADA также делались еженедельно. В течение четырех лет Т-клетки (белые кровяные тельца), продуцируемые стволовыми клетками, вырабатывали ферменты ADA с использованием гена ADA. Через четыре года потребовалось дополнительное лечение.[103]
Смерть Джесси Гелсингера в 1999 г. помешала исследованиям в области генной терапии в США. [104] [105] В результате FDA приостановило несколько клинических испытаний до пересмотра этических и процедурных норм. [106]
2000-е [ править ]
Модифицированная стратегия генной терапии рака антисмысловой РНК IGF-I (NIH n˚ 1602) [100] с использованием подхода антисмысловая / тройная спираль анти-IGF-I была зарегистрирована в 2002 году в клинических испытаниях генной терапии Wiley - n˚ 635 и 636. Этот подход показал многообещающие результаты в лечении шести различных злокачественных опухолей: глиобластомы, рака печени, толстой кишки, простаты, матки и яичников (Совместная научная программа НАТО по генной терапии США, Франция, Польша № LST 980517, проведенная Дж. Трояном. ) (Trojan et al., 2012). Эта антигенная антисмысловая терапия / терапия тройной спирали доказала свою эффективность благодаря механизму одновременной остановки экспрессии IGF-I на уровнях трансляции и транскрипции, усилению противоопухолевых иммунных и апоптотических явлений.
2002 [ править ]
Серповидно-клеточную болезнь можно лечить у мышей. [107] Мыши, у которых, по сути, есть тот же дефект, который вызывает случаи заболевания людей, использовали вирусный вектор, чтобы вызвать выработку фетального гемоглобина (HbF), который обычно перестает вырабатываться вскоре после рождения. У людей использование гидроксимочевины для стимуляции выработки HbF временно облегчает симптомы серповидно-клеточной анемии. Исследователи продемонстрировали, что это лечение является более постоянным средством увеличения терапевтического производства HbF. [108]
Новый подход к генной терапии исправил ошибки в матричной РНК, происходящей из дефектных генов. Этот метод может лечить талассемию , муковисцидоз и некоторые виды рака. [109]
Исследователи создали липосомы диаметром 25 нанометров, которые могут переносить терапевтическую ДНК через поры в ядерной мембране . [110]
2003 [ править ]
В 2003 году группа исследователей впервые ввела гены в мозг. Они использовали липосомы, покрытые полимером под названием полиэтиленгликоль , который, в отличие от вирусных векторов, достаточно мал, чтобы преодолевать гематоэнцефалический барьер . [111]
Короткие фрагменты двухцепочечной РНК (короткие интерферирующие РНК или миРНК ) используются клетками для разрушения РНК определенной последовательности. Если siRNA спроектирована так, чтобы соответствовать РНК, скопированной из дефектного гена, то аномальный белковый продукт этого гена не будет продуцироваться. [112]
Gendicine является генной терапией рака , который обеспечивает супрессор опухолей гена р53 с использованием сконструированного аденовируса . В 2003 году он был одобрен в Китае для лечения плоскоклеточного рака головы и шеи . [33]
2006 [ править ]
В марте исследователи объявили об успешном использовании генной терапии для лечения двух взрослых пациентов от Х-сцепленной хронической гранулематозной болезни , болезни, которая поражает миелоидные клетки и повреждает иммунную систему . Это исследование впервые показывает, что генная терапия может лечить миелоидную систему. [113]
В мае команда ученых сообщила о способе предотвращения отторжения иммунной системой только что доставленного гена. [114] Подобно трансплантации органов , генная терапия страдает от этой проблемы. Система Иммунная обычно распознает новый ген , как иностранного и отвергает клетки , несущие его. В исследовании использовалась недавно обнаруженная сеть генов, регулируемых молекулами, известными как микроРНК . Эта естественная функция избирательно скрывала их терапевтический ген в клетках иммунной системы и защищала его от обнаружения. Мыши, инфицированные геном, содержащим последовательность-мишень микроРНК иммунных клеток, не отклоняли ген.
В августе ученые успешно вылечили метастатическую меланому у двух пациентов, используя Т-клетки-киллеры, генетически перенаправленные для атаки на раковые клетки. [115]
В ноябре исследователи сообщили об использовании VRX496, генной иммунотерапии для лечения ВИЧ, которая использует лентивирусный вектор для доставки антисмыслового гена против оболочки ВИЧ . В фазе I клинического испытания прошли лечение пять субъектов с хронической ВИЧ-инфекцией, которые не ответили как минимум на две схемы антиретровирусной терапии. Однократная внутривенная инфузия аутологичного CD4Т-клетки, генетически модифицированные с помощью VRX496, хорошо переносились. Все пациенты имели стабильную или пониженную вирусную нагрузку; у четырех из пяти пациентов было стабильное или повышенное количество Т-лимфоцитов CD4. У всех пяти пациентов был стабильный или повышенный иммунный ответ на антигены ВИЧ и другие патогены . Это была первая оценка лентивирусного вектора, введенного в клинических испытаниях на людях в США. [116] [117]
2007 [ править ]
В мае исследователи объявили о первом испытании генной терапии наследственного заболевания сетчатки . Первая операция была проведена 23-летнему британцу Роберту Джонсону в начале 2007 года [118].
2008 [ править ]
Врожденный амавроз Лебера - это наследственное заболевание, вызывающее слепоту, вызванное мутациями в гене RPE65 . В апреле были опубликованы результаты небольшого клинического исследования на детях. [5] Доставка рекомбинантного аденоассоциированного вируса (AAV), несущего RPE65, дала положительные результаты. В мае еще две группы сообщили о положительных результатах независимых клинических испытаний с использованием генной терапии для лечения этого состояния. Во всех трех клинических испытаниях у пациентов восстановилось функциональное зрение без явных побочных эффектов. [5] [20] [21] [22]
2009 [ править ]
В сентябре ученые смогли дать трехцветных видение на беличьих обезьян . [119] В ноябре 2009 года исследователи остановили фатальное генетическое заболевание, называемое адренолейкодистрофией, у двух детей, используя лентивирусный вектор для доставки функционирующей версии ABCD1 , гена, мутировавшего при этом заболевании. [120]
2010-е [ править ]
2010 [ править ]
В апрельской статье сообщалось, что генная терапия направлена на ахроматопсию (дальтонизм) у собак путем воздействия на фоторецепторы колбочек . Функция конуса и дневное зрение были восстановлены не менее чем на 33 месяца у двух молодых особей. Для собак старшего возраста терапия была менее эффективной. [121]
В сентябре было объявлено, что 18-летний мужчина во Франции с большой бета-талассемией успешно вылечился. [122] Большая бета-талассемия - это наследственное заболевание крови, при котором отсутствует бета-гемоглобин, а пациенты зависят от регулярных переливаний крови на протяжении всей жизни . [123] В методике использовался лентивирусный вектор для трансдукции гена бета-глобина человека в очищенные клетки крови и костного мозга, полученные от пациента в июне 2007 года. [124]Уровень гемоглобина у пациента был стабильным и составлял от 9 до 10 г / дл. Около трети гемоглобина содержалось в форме, введенной вирусным вектором, и переливания крови не требовались. [124] [125] Планировались дальнейшие клинические испытания. [126] Пересадка костного мозга - единственное лекарство от талассемии, но 75% пациентов не находят подходящего донора. [125]
Иммуногенная терапия рака с использованием модифицированного антигена, антисмысловой / тройной спирали была внедрена в Южной Америке в 2010/11 г. в Университете Ла Сабана, Богота (Этический комитет, 14 декабря 2010 г., № P-004-10). Принимая во внимание этический аспект генной диагностики и генной терапии, нацеленной на IGF-I, лечили опухоли, экспрессирующие IGF-I, то есть рак легких и эпидермиса (Trojan et al., 2016). [127] [128]
2011 [ править ]
В 2007 и 2008 годах мужчина ( Тимоти Рэй Браун ) был излечен от ВИЧ повторной трансплантацией гемопоэтических стволовых клеток (см. Также трансплантацию аллогенных стволовых клеток , аллогенную трансплантацию костного мозга , аллотрансплантацию ) с мутацией двойной дельта-32, которая отключает рецептор CCR5 . Это лекарство было принято медицинским сообществом в 2011 году. [129] Оно потребовало полной абляции существующего костного мозга , что очень изнурительно.
В августе было подтверждено, что двое из трех субъектов пилотного исследования излечились от хронического лимфолейкоза (ХЛЛ). В терапии использовались генетически модифицированные Т-клетки для атаки клеток, экспрессирующих белок CD19, для борьбы с болезнью. [28] В 2013 году исследователи объявили, что 26 из 59 пациентов достигли полной ремиссии, а исходный пациент остался без опухолей. [130]
Человеческий HGF - плазмидная ДНК терапия из кардиомиоцитов в настоящее время рассматривается в качестве потенциального лечения заболевания коронарной артерии , а также лечения за ущерб , который возникает в сердце после инфаркта миокарда . [131] [132]
В 2011 году Неоваскулген был зарегистрирован в России как первый в своем классе генно-терапевтический препарат для лечения заболеваний периферических артерий , в том числе критической ишемии конечностей ; он доставляет ген, кодирующий VEGF . [133] [34] Неоваскулоген представляет собой плазмиду, кодирующую промотор CMV и форму VEGF из 165 аминокислот . [134] [135]
2012 [ править ]
В июле FDA одобрило Фазу 1 клинических испытаний пациентов с основной талассемией в США для 10 участников. [136] Ожидается, что исследование будет продолжено до 2015 года. [126]
В июле 2012 года Европейское агентство по лекарственным средствам впервые рекомендовало одобрить генную терапию в Европе или США. В лечении использовался Алипоген типарвовец (Глибера) для компенсации дефицита липопротеинлипазы , который может вызвать тяжелый панкреатит . [137] Рекомендация была одобрена Европейской Комиссией в ноябре 2012 года [19] [35] [138] [139], и коммерческое внедрение началось в конце 2014 года. [140] Ожидалось, что в 2012 году стоимость лечения препаратом Алипоген типарвовек составит около 1,6 миллиона долларов. , [141] пересмотрено до 1 миллиона долларов в 2015 году, [142]что делает его самым дорогим лекарством в мире в то время. [143] По состоянию на 2016 год [Обновить]препарат получали только пациенты, прошедшие клинические испытания, и пациент, заплативший полную цену за лечение. [144]
В декабре 2012 года сообщалось, что 10 из 13 пациентов с множественной миеломой находились в стадии ремиссии «или очень близко к ней» через три месяца после инъекции лечения с использованием генно-инженерных Т-клеток для нацеливания на белки NY-ESO-1 и LAGE-1. , которые существуют только на клетках раковой миеломы. [30]
2013 [ править ]
В марте исследователи сообщили, что трое из пяти взрослых пациентов с острым лимфолейкозом (ОЛЛ) находились в стадии ремиссии от пяти месяцев до двух лет после лечения генетически модифицированными Т-клетками, которые атаковали клетки с генами CD19 на своей поверхности, то есть все B- клетки , раковые или нет. Исследователи полагали, что иммунная система пациентов вырабатывает нормальные Т-клетки и В-клетки через пару месяцев. Им также дали костный мозг. У одного пациента случился рецидив и он умер, а один умер от тромба, не связанного с болезнью. [29]
После обнадеживающих испытаний фазы 1 в апреле исследователи объявили, что они начинают клинические испытания фазы 2 (названные CUPID2 и SERCA-LVAD) на 250 пациентах [145] в нескольких больницах для борьбы с сердечными заболеваниями . Терапия была разработана для повышения уровня SERCA 2, протеина в сердечных мышцах, улучшающего мышечную функцию. [146] FDA получил это прорыв терапии Обозначение для ускорения судебного процесса и утверждения. [147] В 2016 году сообщалось, что в исследовании CUPID 2 не было обнаружено никаких улучшений. [148]
В июле исследователи сообщили об обнадеживающих результатах для шести детей с двумя тяжелыми наследственными заболеваниями, которых лечили частично дезактивированным лентивирусом для замены дефектного гена и через 7–32 месяцев. У троих детей была метахроматическая лейкодистрофия , из-за которой дети теряли когнитивные и двигательные навыки. [149] У других детей был синдром Вискотта – Олдрича , из-за которого они подвержены инфекциям, аутоиммунным заболеваниям и раку. [150] Последующие испытания генной терапии на еще шести детях с синдромом Вискотта – Олдрича также были многообещающими. [151] [152]
В октябре исследователи сообщили, что двое детей, родившихся с тяжелым комбинированным иммунодефицитным заболеванием аденозиндезаминазы ( ADA-SCID ), получали лечение с помощью генно-инженерных стволовых клеток 18 месяцев назад, и что их иммунная система демонстрирует признаки полного выздоровления. Еще трое детей добивались успехов. [26] В 2014 году еще 18 детей с ADA-SCID были излечены с помощью генной терапии. [153] У детей с ADA-SCID нет функционирующей иммунной системы, и их иногда называют «детьми пузырей». [26]
Также в октябре исследователи сообщили, что в начале 2011 года они вылечили шестерых больных гемофилией с помощью аденоассоциированного вируса. Более двух лет спустя все шесть производили фактор свертывания крови . [26] [154]
2014 [ править ]
В январе исследователи сообщили , что шесть хороидермия пациентов лечились адено-ассоциированный вирусом с копией REP1 . За период от шести месяцев до двух лет у всех улучшилось зрение. [6] [155] К 2016 году 32 пациента прошли лечение с положительными результатами, и исследователи надеялись, что лечение будет длительным. [23] Хоридеремия - наследственное генетическое заболевание глаз, не требующее одобрения лечения и приводящее к потере зрения.
В марте исследователи сообщили, что с 2009 года 12 пациентов с ВИЧ лечились с помощью генно-инженерного вируса с редкой мутацией ( дефицит CCR5 ), которая, как известно, защищает от ВИЧ, с многообещающими результатами. [156] [157]
Клинические испытания генной терапии серповидноклеточной анемии были начаты в 2014 году. [158] [159]
В феврале LentiGlobin BB305 , генная терапия, проходящая клинические испытания для лечения бета-талассемии, получила статус «прорыва» FDA после того, как несколько пациентов смогли отказаться от частых переливаний крови, обычно необходимых для лечения болезни. [160]
В марте исследователи доставили рекомбинантный ген, кодирующий широко нейтрализующие антитела, обезьянам, инфицированным обезьяньим ВИЧ ; клетки обезьян производили антитела , которые очищали их от ВИЧ. Этот метод получил название иммунопрофилактика путем переноса генов (IGT). Испытания на животных на антитела к лихорадке Эбола, малярия, грипп и гепатит продолжаются. [161] [162]
В марте ученые, в том числе изобретательница CRISPR , Дженнифер Дудна , призвали к введению во всем мире моратория на генную терапию зародышевой линии, написав, что «в слабых юрисдикциях ученые должны избегать даже попыток модификации генома зародышевой линии для клинического применения на людях», пока не будут выявлены все последствия ». обсуждается в научных и государственных организациях ». [68] [69] [70] [71]
В октябре исследователи объявили, что вылечили девочку, Лейлу Ричардс, экспериментальным лечением с использованием донорских Т-клеток, генетически созданных с использованием TALEN для борьбы с раковыми клетками. Спустя год после лечения у нее все еще не было рака (очень агрессивной формы острого лимфобластного лейкоза [ОЛЛ]). [163] Дети с очень агрессивным ОЛЛ обычно имеют очень плохой прогноз, и болезнь Лейлы считалась смертельной до лечения. [164]
В декабре ученые крупных мировых академий призвали к мораторию на наследуемом геном человека правки, в том числе связанного с CRISPR-cas9 технологий [165] , но это фундаментальные исследования , включая эмбрион редактирование генов должно продолжаться. [166]
2015 [ править ]
Исследователи успешно вылечили мальчика с буллезным эпидермолизом, используя кожные трансплантаты, выращенные из его собственных клеток кожи, генетически измененные для исправления мутации, вызвавшей его болезнь. [167]
2016 [ править ]
В апреле Комитет по лекарственным препаратам для человека в Европейское агентство по лекарственным средствам одобрила лечение генной терапии под названием Strimvelis [168] [169] и Европейская комиссия одобрила его в июне. [170] Здесь лечат детей, рожденных с дефицитом аденозиндезаминазы и у которых отсутствует функционирующая иммунная система. Это был второй метод генной терапии, одобренный в Европе. [171]
В октябре китайские ученые сообщили, что они начали испытание по генетической модификации Т-клеток у 10 взрослых пациентов с раком легких и повторной инъекции модифицированных Т-клеток обратно в их тела, чтобы атаковать раковые клетки. У Т-клеток был удален белок PD-1 (который останавливает или замедляет иммунный ответ) с использованием CRISPR-Cas9. [172] [173]
Кокрановский систематический обзор 2016 года, посвященный данным четырех исследований местной генной терапии с помощью регулятора трансмембранной проводимости при муковисцидозе (CFTR), не поддерживает его клиническое использование в качестве тумана, вдыхаемого в легкие, для лечения пациентов с муковисцидозом и легочными инфекциями. Одно из четырех испытаний действительно обнаружило слабые доказательства того, что терапия с переносом гена CFTR на основе липосом может привести к небольшому улучшению дыхательной функции у людей с МВ. Этого слабого доказательства недостаточно, чтобы дать клиническую рекомендацию для рутинной генной терапии CFTR. [174]
2017 [ править ]
В феврале Kite Pharma объявила о результатах клинических испытаний CAR-T- клеток примерно у сотни человек с прогрессирующей неходжкинской лимфомой . [175]
В марте французские ученые сообщили о клинических исследованиях генной терапии для лечения серповидно-клеточной анемии . [176]
В августе FDA одобрило tisagenlecleucel для лечения острого лимфобластного лейкоза. [177] Tisagenlecleucel представляет собой адоптивную терапию с переносом клеток при В-клеточном остром лимфобластном лейкозе ; Т-клетки человека, страдающего раком, удаляются, генетически модифицированы для создания специфического Т-клеточного рецептора (химерного Т-клеточного рецептора или «CAR-T»), который реагирует на рак, и вводятся обратно человеку. Т-клетки сконструированы так, чтобы нацеливаться на белок CD19, который является обычным для В-клеток. Это первая форма генной терапии, одобренная в США. В октябре аналогичная терапия назвалаaxicabtagene ciloleucel был одобрен для лечения неходжкинской лимфомы . [178]
В октябре биофизик и биохакер Джозия Зайнер заявил, что провел первое редактирование генома человека in vivo в форме самостоятельной терапии. [179] [180]
13 ноября ученые-медики, работающие с Sangamo Therapeutics , штаб-квартира которой находится в Ричмонде, штат Калифорния , объявили о первой в истории терапии человеческого генного редактирования . [181] [182] Лечение, предназначенное для постоянной вставки здоровой версии дефектного гена, вызывающего синдром Хантера , было проведено 44-летнему Брайану Мэдуксу и является частью первого в мире исследования по постоянному редактированию ДНК внутри человека. тело. [183] Успех вставки гена был позже подтвержден. [184] [185] Сангамо проводит клинические испытания редактирования генов с использованием нуклеазы цинковых пальцев (ZFN).[186]
В декабре были опубликованы результаты использования аденоассоциированного вируса с фактором свертывания крови VIII для лечения девяти пациентов с гемофилией А. У шести из семи пациентов, получавших режим высоких доз, уровень свертывания крови VIII повысился до нормального. Режимы низких и средних доз не влияли на уровень свертываемости крови пациента. [187] [188]
В декабре FDA одобрило Luxturna , первую генную терапию in vivo , для лечения слепоты из-за врожденного амавроза Лебера . [189] Стоимость лечения составила 850 000 долларов США за оба глаза. [190] [191]
2019 [ править ]
В мае FDA одобрило онасемноген абепарвовец (Золгенсма) для лечения спинальной мышечной атрофии у детей в возрасте до двух лет. Прейскурантная цена Золгенсмы была установлена на уровне 2,125 миллиона долларов США за дозу, что сделало его самым дорогим лекарством за всю историю. [192]
В мае EMA одобрило betibeglogene autotemcel (Zynteglo) для лечения бета-талассемии у людей от двенадцати лет и старше. [193] [194]
В июле Allergan и Editas медицина объявила фазу 1/2 клинических испытания AGN-151587 для лечения Лебера врожденной слепоты 10. [195] Это первое исследование в CRISPR -О в естественных условиях человеческого гена редактирования терапии , где редактирование происходит внутри человеческого тела. [196] Первая инъекция системы CRISPR-Cas была подтверждена в марте 2020 года. [197]
2020-е [ править ]
2020 [ править ]
В мае онасемноген абепарвовец (Золгенсма) был одобрен Европейским союзом для лечения спинальной мышечной атрофии у людей, у которых либо есть клинические симптомы СМА типа 1, либо у которых есть 2 или 3 копии гена SMN2 , независимо от массы тела или возраста. . [198]
В августе Audentes Therapeutics сообщила, что трое из 17 детей с Х-сцепленной миотубулярной миопатией, участвовавших в клинических испытаниях генной терапии AT132 на основе AAV8, умерли. Было высказано предположение, что лечение, дозировка которого основана на массе тела, оказывает непропорционально токсичное действие на более тяжелых пациентов, поскольку трое умерших пациентов были тяжелее остальных. [199] [200] Исследование приостановлено. [201]
15 октября Комитет по лекарственным средствам для человека (CHMP) Европейского агентства по лекарственным средствам (EMA) принял положительное заключение, рекомендуя выдачу разрешения на продажу лекарственного препарата Libmeldy (аутологичная популяция, обогащенная клетками CD34 +, содержащая гемопоэтические стволовые клетки). и клетки-предшественники, трансдуцированные ex vivo с использованием лентивирусного вектора, кодирующего ген арилсульфатазы A человека), генная терапия для лечения детей с «поздней инфантильной» (LI) или «раннеювенильной» (EJ) формами метахроматической лейкодистрофии (MLD) . [202] Активное вещество Либмельди состоит из собственных стволовых клеток ребенка, которые были модифицированы, чтобы содержать рабочие копии гена ARSA. [202]Когда модифицированные клетки вводятся обратно пациенту в виде одноразовой инфузии, ожидается, что клетки начнут вырабатывать фермент ARSA, который разрушает накопление сульфатидов в нервных клетках и других клетках тела пациента. [203] Либмельди был одобрен для медицинского применения в ЕС в декабре 2020 года. [204]
15 октября французская биотехнологическая компания Lysogen сообщила о смерти пациента, получившего LYS-SAF302, экспериментальную генную терапию для лечения мукополисахаридоза типа IIIA (синдром Санфилиппо типа A). [205]
Популярная культура [ править ]
Генная терапия является основой сюжета фильма « Я - легенда» [206] и телешоу « Изменит ли генная терапия человеческую расу?» . [207] В 1994 году генная терапия была элементом сюжета в « Фляге Эрленмейера », финале первого сезона «Секретных материалов» ; он также используется в Звездных вратах как средство, позволяющее людям использовать древние технологии. [208] [209]
См. Также [ править ]
- Антисмысловая терапия
- Биоэтика
- Органический синтез на основе шаблонов ДНК
- ДНК-вакцинация
- Редактирование эпигенома
- Генная терапия дальтонизма
- Генная терапия эпилепсии
- Генная терапия остеоартрита
- Генная терапия при болезни Паркинсона
- Генная инженерия
- Список генных терапий
- ВОЛШЕБНЫЙ
- Синтетическая летальность
- Синтетическое спасение
- Терапевтическая генная модуляция
Ссылки [ править ]
- ↑ Каджи, Юджин Х. (7 февраля 2001 г.). «Генная терапия и лечение стволовыми клетками» . ДЖАМА . 285 (5): 545–550. DOI : 10,1001 / jama.285.5.545 . ISSN 0098-7484 . PMID 11176856 .
- Перейти ↑ Ermak G (2015). Новые медицинские технологии . World Scientific. ISBN 978-981-4675-81-9.
- ^ Розенберг С.А., Эберсолд П., Корнетта К., Касид А., Морган Р.А., Моэн Р. и др. (Август 1990 г.). «Перенос генов человеку - иммунотерапия пациентов с запущенной меланомой с использованием инфильтрирующих опухоль лимфоцитов, модифицированных ретровирусной трансдукцией гена». Медицинский журнал Новой Англии . 323 (9): 570–578. DOI : 10.1056 / NEJM199008303230904 . PMID 2381442 .
- ^ a b Всемирная база данных клинических испытаний генной терапии . Журнал генной медицины . Wiley (июнь 2016 г.)
- ^ а б в г Магуайр А.М., Симонелли Ф., Пирс Э.А., Пью Э.Н., Мингоцци Ф., Бенничелли Дж. и др. (Май 2008 г.). «Безопасность и эффективность переноса генов при врожденном амаврозе Лебера» . Медицинский журнал Новой Англии . 358 (21): 2240–2248. DOI : 10.1056 / NEJMoa0802315 . PMC 2829748 . PMID 18441370 .
- ^ a b MacLaren RE, Groppe M, Barnard AR, Cottriall CL, Tolmachova T, Seymour L, Clark KR, Во время MJ, Cremers FP, Black GC, Lotery AJ, Downes SM, Webster AR, Seabra MC (март 2014 г.). «Генная терапия сетчатки у пациентов с хориидеремией: первые результаты клинических испытаний фазы 1/2» . Ланцет . 383 (9923): 1129–1137. DOI : 10.1016 / S0140-6736 (13) 62117-0 . PMC 4171740 . PMID 24439297 .
- ^ a b Бак Р.О., Гомес-Оспина Н., Портеус М.Х. (август 2018 г.). «Генное редактирование в центре внимания». Тенденции в генетике . 34 (8): 600–611. DOI : 10.1016 / j.tig.2018.05.004 . PMID 29908711 .
- ^ Девер Д.П., Бак Р.О., Райниш А., Камарена Дж., Вашингтон Г., Николас С.Э. и др. (Ноябрь 2016 г.). «Нацеливание на ген β-глобина CRISPR / Cas9 в гемопоэтических стволовых клетках человека» . Природа . 539 (7629): 384–389. Bibcode : 2016Natur.539..384D . DOI : 10,1038 / природа20134 . PMC 5898607 . PMID 27820943 .
- ^ Гупта RM, Musunuru K (октябрь 2014). «Расширение набора инструментов генетического редактирования: ZFN, TALEN и CRISPR-Cas9» . Журнал клинических исследований . 124 (10): 4154–61. DOI : 10.1172 / JCI72992 . PMC 4191047 . PMID 25271723 .
- ^ Sanches-да-Сильва Г.Н., Medeiros Л.Ф., Лима FM (21 августа 2019). «Возможное использование системы CRISPR-Cas для генной терапии ВИЧ-1» . Международный журнал геномики . 2019 : 8458263. дои : 10,1155 / 2019/8458263 . PMC 6721108 . PMID 31531340 .
- ^ Патент: US7824869B2
- ↑ Bi A, Cui J, Ma YP, Olshevskaya E, Pu M, Dizhoor AM, Pan ZH (апрель 2006 г.). «Эктопическая экспрессия родопсина микробного типа восстанавливает зрительные реакции у мышей с дегенерацией фоторецепторов» . Нейрон . 50 (1): 23–33. DOI : 10.1016 / j.neuron.2006.02.026 . PMC 1459045 . PMID 16600853 .
- ↑ Zimmer C (16 сентября 2013 г.). "Двойной дубль ДНК" . Нью-Йорк Таймс .
- ^ Конгресс США, Управление оценки технологий (декабрь 1984 г.). Генная терапия человека - справочный документ . ДИАНА Паблишинг. ISBN 978-1-4289-2371-3.
- ↑ Sun M (октябрь 1982 г.). «Мартин Клайн проиграл апелляцию на грант NIH». Наука . 218 (4567): 37. Bibcode : 1982Sci ... 218 ... 37S . DOI : 10.1126 / science.7123214 . PMID 7123214 .
- ^ Левенштейна P (2008). "Генная терапия неврологических расстройств: новые методы лечения или эксперименты на людях?" . В Берли Дж, Харрис Дж (ред.). Товарищ по генетике . Джон Вили и сыновья. ISBN 978-0-470-75637-9.
- ^ a b Шеридан C (февраль 2011 г.). «Генная терапия находит свою нишу». Природа Биотехнологии . 29 (2): 121–128. DOI : 10.1038 / nbt.1769 . PMID 21301435 . S2CID 5063701 .
- ↑ Oldfield EH, Ram Z, Culver KW, Blaese RM, DeVroom HL, Anderson WF (февраль 1993 г.). «Генная терапия для лечения опухолей головного мозга с использованием внутриопухолевой трансдукции с геном тимидинкиназы и внутривенного введения ганцикловира». Генная терапия человека . 4 (1): 39–69. DOI : 10.1089 / hum.1993.4.1-39 . PMID 8384892 .
- ^ a b c Ричардс S (6 ноября 2012 г.). «Генная терапия приходит в Европу» . Ученый .
- ^ а б Симонелли Ф., Магуайр А.М., Теста Ф., Пирс Э.А., Мингоцци Ф., Бенничелли Дж. Л. и др. (Март 2010 г.). «Генная терапия врожденного амавроза Лебера безопасна и эффективна через 1,5 года после введения вектора» . Молекулярная терапия . 18 (3): 643–650. DOI : 10.1038 / mt.2009.277 . PMC 2839440 . PMID 19953081 .
- ^ a b Cideciyan AV, Hauswirth WW, Aleman TS, Kaushal S, Schwartz SB, Boye SL, Windsor EA, Conlon TJ, Sumaroka A, Roman AJ, Byrne BJ, Jacobson SG (август 2009 г.). «Зрение через год после генной терапии врожденного амавроза Лебера» . Медицинский журнал Новой Англии . 361 (7): 725–727. DOI : 10.1056 / NEJMc0903652 . PMC 2847775 . PMID 19675341 .
- ^ a b Бейнбридж Дж. У., Смит А. Дж., Баркер С. С., Робби С., Хендерсон Р., Балагган К. и др. (Май 2008 г.). «Влияние генной терапии на зрительную функцию при врожденном амаврозе Лебера». Медицинский журнал Новой Англии . 358 (21): 2231–2239. DOI : 10.1056 / NEJMoa0802268 . PMID 18441371 .
- ^ a b Ghosh P (28 апреля 2016 г.). «Генная терапия отменяет потерю зрения и длится долго» . BBC News Online . Проверено 29 апреля 2016 года .
- ^ Фишер A, Hacein-бей-Abina S, Cavazzana-Кальво M (июнь 2010). «20 лет генной терапии SCID». Иммунология природы . 11 (6): 457–460. DOI : 10.1038 / ni0610-457 . PMID 20485269 . S2CID 11300348 .
- ^ Ferrua F, Бригитта I, Aiuti A (декабрь 2010). «Обновленная информация о генной терапии тяжелого комбинированного иммунодефицита с дефицитом аденозиндезаминазы». Текущее мнение в области аллергии и клинической иммунологии . 10 (6): 551–556. DOI : 10.1097 / ACI.0b013e32833fea85 . PMID 20966749 . S2CID 205435278 .
- ^ a b c d e Геддес, Линда (30 октября 2013 г.) Успех «ребенка пузыря» возвращает генную терапию в нужное русло . Новый Ученый . Проверено 2 ноября 2013 г.
- ^ Картье N, Aubourg P (июль 2010). «Трансплантация гемопоэтических стволовых клеток и генная терапия гемопоэтических стволовых клеток при Х-сцепленной адренолейкодистрофии». Патология головного мозга . 20 (4): 857–862. DOI : 10.1111 / j.1750-3639.2010.00394.x . PMID 20626747 . S2CID 24182017 .
- ^ а б Ледфорд Х (2011). «Клеточная терапия борется с лейкемией». Природа . DOI : 10.1038 / news.2011.472 .
- ↑ a b Coghlan A (26 марта 2013 г.). «Генная терапия излечивает лейкоз за восемь дней» . Новый Ученый . Проверено 15 апреля 2013 года .
- ↑ a b Coghlan A (11 декабря 2013 г.). «Активные иммунные клетки заставляют лейкоз перейти в стадию ремиссии» . Новый ученый . Проверено 15 апреля 2013 года .
- ^ LeWitt PA, Rezai AR, Leehey MA, Ojemann SG, Flaherty AW, Eskandar EN, et al. (Апрель 2011 г.). «Генная терапия AAV2-GAD для запущенной болезни Паркинсона: двойное слепое рандомизированное исследование, контролируемое фиктивным хирургическим вмешательством». Ланцет. Неврология . 10 (4): 309–319. DOI : 10.1016 / S1474-4422 (11) 70039-4 . PMID 21419704 . S2CID 37154043 .
- ^ Herper M (26 марта 2014). «Большое возвращение генной терапии» . Forbes . Проверено 28 апреля 2014 года .
- ^ а б Пирсон С., Джиа Х, Кандачи К. (январь 2004 г.). «Китай одобряет первую генную терапию» . Природа Биотехнологии . 22 (1): 3–4. DOI : 10.1038 / nbt0104-3 . PMC 7097065 . PMID 14704685 .
- ^ a b «Одобрено генной терапией для ЗПА» . 6 декабря 2011 . Дата обращения 5 августа 2015 .
- ^ a b c Галлахер, Джеймс. (2 ноября 2012 г.) Генная терапия: Глибера одобрена Европейской комиссией . Новости BBC. Проверено 15 декабря 2012 года.
- ^ Национальная медицинская библиотека США, Домашний справочник по геномике. Что такое генная терапия? Архивировано 6 апреля 2016 года в Wayback Machine.
- ^ Национальная медицинская библиотека США, Домашний справочник по геномике. Как работает генная терапия?
- ^ Pezzoli D, Chiesa R, De L Нардо, Candiani G (сентябрь 2012). «Нам еще предстоит пройти долгий путь для эффективной доставки генов!». Журнал прикладных биоматериалов и функциональных материалов . 10 (2): 82–91. DOI : 10.5301 / JABFM.2012.9707 . PMID 23015375 . S2CID 6283455 .
- ^ Vannucci L, M Lai, Chiuppesi F, Чеккерини-Nelli L, M Pistello (январь 2013). «Вирусные векторы: взгляд назад и вперед на технологию переноса генов». Новая микробиология . 36 (1): 1-22. PMID 23435812 .
- ^ Gothelf А, J Gehl (ноябрь 2012 года). «Что вам всегда нужно было знать о ДНК-вакцинах на основе электропорации» . Человеческие вакцины и иммунотерапевтические препараты . 8 (11): 1694–1702. DOI : 10.4161 / hv.22062 . PMC 3601144 . PMID 23111168 .
- ↑ Урнов FD, Rebar EJ, Holmes MC, Zhang HS, Грегори PD (сентябрь 2010 г.). «Редактирование генома с помощью сконструированных нуклеаз цинковых пальцев». Природа Обзоры Генетики . 11 (9): 636–646. DOI : 10.1038 / nrg2842 . PMID 20717154 . S2CID 205484701 .
- ^ Стоун Д, Niyonzima Н, Джером КР (сентябрь 2016). «Редактирование генома и противовирусная терапия нового поколения» . Генетика человека . 135 (9): 1071–82. DOI : 10.1007 / s00439-016-1686-2 . PMC 5002242 . PMID 27272125 .
- ↑ Cross D, Burmester JK (сентябрь 2006 г.). «Генная терапия для лечения рака: прошлое, настоящее и будущее» . Клиническая медицина и исследования . 4 (3): 218–27. DOI : 10,3121 / cmr.4.3.218 . PMC 1570487 . PMID 16988102 .
- ^ Maeder ML, Gersbach CA (март 2016). «Технологии редактирования генома для генной и клеточной терапии» . Молекулярная терапия . 24 (3): 430–46. DOI : 10.1038 / mt.2016.10 . PMC 4786923 . PMID 26755333 .
- ^ «Тесты показывают, что ученые достигли 1-го« в теле »редактирования генов» . AP NEWS . 7 февраля 2019 . Дата обращения 17 ноября 2020 .
- ^ "Первая дозированная терапия CRISPR" . Природа Биотехнологии . 38 (4): 382. 1 апреля 2020 г. doi : 10.1038 / s41587-020-0493-4 . ISSN 1546-1696 . PMID 32265555 . S2CID 215406440 .
- ^ Williams DA, Orkin SH (апрель 1986). «Соматическая генная терапия. Текущее состояние и перспективы на будущее» . Журнал клинических исследований . 77 (4): 1053–6. DOI : 10.1172 / JCI112403 . PMC 424438 . PMID 3514670 .
- ^ Mavilio F, G Ferrari (июль 2008). «Генетическая модификация соматических стволовых клеток. Развитие, проблемы и перспективы новой терапевтической технологии» . EMBO Reports . 9 Дополнение 1: S64–69. DOI : 10.1038 / embor.2008.81 . PMC 3327547 . PMID 18578029 .
- ^ a b c «Международное право» . Центр генетики и государственной политики Берманского института биоэтики Университета Джона Хопкинса. 2010. Архивировано из оригинального 2 -го сентября 2014 года.
- ^ Strachnan T, Read AP (2004). Молекулярная генетика человека (3-е изд.). Издательство Гарленд. п. 616 . ISBN 978-0-8153-4184-0.
- Перейти ↑ Hanna K (2006). «Перенос гена зародышевой линии» . Национальный институт исследования генома человека.
- ^ «Клонирование человека и генетическая модификация» . Ассоциация должностных лиц репродуктивного здоровья. 2013. Архивировано из оригинала 18 июня 2013 года .
- ^ «Генная терапия» . ama-assn.org . 4 апреля 2014 . Проверено 22 марта 2015 года .
- ^ Бертран Н., Гренье П., Махмуди М., Лима Е.М., Аппель Е.А., Дормонт Ф. и др. (Октябрь 2017 г.). «Механистическое понимание образования короны белка in vivo на полимерных наночастицах и влияние на фармакокинетику» . Nature Communications . 8 (1): 777. Bibcode : 2017NatCo ... 8..777B . DOI : 10.1038 / s41467-017-00600-ш . PMC 5626760 . PMID 28974673 .
- ^ "Генный допинг ВАДА" . ВАДА. Архивировано из оригинального 21 ноября 2009 года . Проверено 27 сентября 2013 года .
- ^ Кайзер B, Mauron A, Миа A (март 2007). «Текущая антидопинговая политика: критическая оценка» . BMC Medical Ethics . 8 : 2. дои : 10,1186 / 1472-6939-8-2 . PMC 1851967 . PMID 17394662 .
- Перейти ↑ Powell R, Buchanan A (февраль 2011 г.). «Разрыв цепей эволюции: перспектива преднамеренной генетической модификации в организме человека». Журнал медицины и философии . 36 (1): 6–27. DOI : 10.1093 / JMP / jhq057 . PMID 21228084 .
- ^ Baylis F, Роберт JS (2004). «Неизбежность технологий генетического улучшения». Биоэтика . 18 (1): 1-26. DOI : 10.1111 / j.1467-8519.2004.00376.x . PMID 15168695 .
- Перейти ↑ Evans J (2002). Играя в Бога ?: Генная инженерия человека и рационализация общественных биоэтических дебатов . Издательство Чикагского университета. ISBN 978-0-226-22262-2.
- ^ Генная терапия и генная инженерия. Архивировано 3 декабря 2013 года в Wayback Machine, Центре этики здоровья, Медицинский факультет Университета Миссури. 25 апреля 2013 г.
- ^ Roco MC, Bainbridge WS (2002). «Конвергентные технологии для повышения производительности человека: интеграция с наномасштаба». Журнал исследований наночастиц . 4 (4): 281–295. Bibcode : 2002JNR ..... 4..281R . DOI : 10,1023 / A: 1021152023349 . S2CID 136290217 .
- ^ Allhoff F (март 2005). «Генетическое улучшение зародышевой линии и сырье Ролза» (PDF) . Журнал Института этики Кеннеди . 15 (1): 39–56. CiteSeerX 10.1.1.566.171 . DOI : 10.1353 / ken.2005.0007 . PMID 15881795 . S2CID 14432440 .
- ^ Ranisch R (январь 2020). «Специальный выпуск: редактирование зародышевой линии человека» . Биоэтика . 34 (1): 1–143.
- ^ «Этические вопросы, связанные с пренатальным генетическим тестированием. Совет по этическим и судебным вопросам, Американская медицинская ассоциация». Архив семейной медицины . 3 (7): 633–642. Июль 1994 г. doi : 10.1001 / archfami.3.7.633 . PMID 7921302 .
- ^ Декларация Инуямы: картирование генома человека, генетический скрининг и генная терапия . cioms.ch
- Перейти ↑ Smith KR, Chan S, Harris J (октябрь 2012 г.). «Генетическая модификация зародышевой линии человека: научные и биоэтические перспективы». Архив медицинских исследований . 43 (7): 491–513. DOI : 10.1016 / j.arcmed.2012.09.003 . PMID 23072719 .
- ↑ Рирдон S (14 февраля 2017 г.). «Американские советники по науке намечают путь к генетически модифицированным младенцам» . Природа . DOI : 10.1038 / nature.2017.21474 .
- ↑ a b Wade N (19 марта 2015 г.). «Ученые добиваются запрета на метод редактирования генома человека» . Нью-Йорк Таймс . Проверено 20 марта 2015 года .
- ^ a b Pollack A (3 марта 2015 г.). «Новый мощный способ редактирования ДНК» . Нью-Йорк Таймс . Проверено 20 марта 2015 года .
- ^ а б Балтимор Д., Берг П., Ботчан М., Кэрролл Д., Чаро Р.А., Черч Г. и др. (Апрель 2015 г.). «Биотехнология. Разумный путь вперед для геномной инженерии и модификации генов зародышевой линии» . Наука . 348 (6230): 36–38. Bibcode : 2015Sci ... 348 ... 36B . DOI : 10.1126 / science.aab1028 . PMC 4394183 . PMID 25791083 .
- ^ a b Lanphier E, Urnov F, Haecker SE, Werner M, Smolenski J (март 2015 г.). «Не редактируйте зародышевую линию человека» . Природа . 519 (7544): 410–411. Bibcode : 2015Natur.519..410L . DOI : 10.1038 / 519410a . PMID 25810189 .
- ^ Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, Lv J, Xie X, Chen Y, Li Y, Sun Y, Bai Y, Songyang Z, Ma W, Zhou C, Huang J (май 2015). «CRISPR / Cas9-опосредованное редактирование генов в трехъядерных зиготах человека» . Белки и клетки . 6 (5): 363–372. DOI : 10.1007 / s13238-015-0153-5 . PMC 4417674 . PMID 25894090 .
- ^ Kolata G (23 апреля 2015). «Китайские ученые редактируют гены эмбрионов человека, вызывая опасения» . Нью-Йорк Таймс . Проверено 24 апреля 2015 года .
- ↑ Harmon A (14 февраля 2017 г.). «Редактирование генов человека получает поддержку научной комиссии» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 17 февраля 2017 года .
- ^ Комитет по редактированию генов человека: научные, медицинские и этические соображения. «Редактирование генома человека: наука, этика и управление» . nationalacademies.org . Национальная академия наук; Национальная медицинская академия . Проверено 21 февраля 2017 года .CS1 maint: несколько имен: список авторов ( ссылка )
- ^ "Ученые ОК генно-инженерных младенцев" . New York Post . Рейтер. 14 февраля 2017 . Проверено 17 февраля 2017 года .
- ^ a b Olowoyeye, Abiola; Оквунду, Чарльз I. (ноябрь 2020 г.). «Генная терапия серповидноклеточной анемии» . Кокрановская база данных систематических обзоров . 11 : CD007652. DOI : 10.1002 / 14651858.CD007652.pub7 . ISSN 1469-493X . PMID 33251574 .
- ^ Кортоф Г. "Последствия обратной связи сомы к зародышевой линии Стила для генной терапии человека" .
- ^ Woods Н.Б., Bottero V, Schmidt M, фон Kalle C, Верма IM (апрель 2006). «Генная терапия: терапевтический ген, вызывающий лимфому» . Природа . 440 (7088): 1123. Bibcode : 2006Natur.440.1123W . DOI : 10.1038 / 4401123a . PMID 16641981 . S2CID 4372110 .
- ^ Thrasher AJ, Gaspar HB, Baum C, Modlich U, Schambach A, Candotti F, et al. (Сентябрь 2006 г.). «Генная терапия: лейкемогенность трансгена X-SCID». Природа . 443 (7109): E5-6, обсуждение E6-7. Bibcode : 2006Natur.443E ... 5T . DOI : 10,1038 / природа05219 . PMID 16988659 . S2CID 4301764 .
- ↑ Bak RO, Porteus MH (июль 2017 г.). «CRISPR-опосредованная интеграция больших генных кассет с использованием донорных векторов AAV» . Отчеты по ячейкам . 20 (3): 750–756. DOI : 10.1016 / j.celrep.2017.06.064 . PMC 5568673 . PMID 28723575 .
- ^ Rojahn SY (11 февраля 2014). «Хирургия генома» . Обзор технологий Массачусетского технологического института . Проверено 17 февраля 2014 года .
- ^ Генной терапии нужен герой, чтобы оправдать ажиотаж . New Scientist (31 октября 2013 г.). Проверено 2 ноября 2012 г.
- ^ Crasto AM (7 июля 2013). «Глибера - самый дорогой препарат в мире и первая одобренная генная терапия на Западе» . Все о наркотиках . Проверено 2 ноября 2013 года .
- ^ ORNL.gov . ORNL.gov. Проверено 15 декабря 2012 года.
- ^ Raper SE, Chirmule N, Lee FS, Wivel NA, Bagg A, Gao GP и др. (Сентябрь 2003 г.). «Синдром фатального системного воспалительного ответа у пациента с дефицитом орнитин-транскарбамилазы после переноса аденовирусного гена». Молекулярная генетика и метаболизм . 80 (1–2): 148–58. DOI : 10.1016 / j.ymgme.2003.08.016 . PMID 14567964 .
- ^ Фрэнк К.М., Хогарт Д.К., Миллер Дж. Л., Мандал С., Миз П. Дж., Самульски Р. Дж. И др. (Июль 2009 г.). «Исследование причины смерти в испытании генной терапии». Медицинский журнал Новой Англии . 361 (2): 161–9. DOI : 10.1056 / NEJMoa0801066 . PMID 19587341 .
- ^ Организация генома человека. Комитет по этике HUGO (апрель 2001 г.). Заявление об исследованиях генной терапии .
- ^ Isasi RM, Nguyen TM, Knoppers BM (октябрь 2006). «Национальная нормативно-правовая база в отношении технологий генетической модификации человека (соматическая модификация и модификация зародышевой линии)» (PDF) . Центр генетики и общественной политики. Архивировано из оригинального (PDF) 17 сентября 2014 года.
- ^ a b Национальные институты здоровья. Руководство NIH по исследованиям молекул рекомбинантных или синтетических нуклеиновых кислот . Пересмотрено в апреле 2016 г.
- ^ Министерство здравоохранения и социальных служб США. Национальная комиссия по защите людей в рамках биомедицинских и поведенческих исследований. Отчет Бельмона: Этические принципы и рекомендации по защите людей - субъектов исследования . 18 апреля 1979 г.
- ^ Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (14 октября 1993 г.). «Применение действующих законодательных органов к продуктам терапии соматическими клетками человека и продуктам генной терапии» (PDF) . Федеральный регистр . 58 (197).
- ^ Министерство здравоохранения и социальных служб США. Управление по контролю за продуктами и лекарствами. Центр оценки и исследований биологических препаратов. Руководство для промышленности: Руководство по терапии соматическими клетками человека и генной терапии . Март 1998 г.
- ↑ Friedmann T, Roblin R (март 1972 г.). «Генная терапия генетических заболеваний человека?». Наука . 175 (4025): 949–955. Bibcode : 1972Sci ... 175..949F . DOI : 10.1126 / science.175.4025.949 . PMID 5061866 . S2CID 19952096 .
- Перейти ↑ Rogers S, New Scientist 1970, p. 194
- ^ Cepko CL, Робертс BE Маллиган RC (июль 1984). «Создание и применение челночного вектора мышиного ретровируса с высокой степенью трансмиссии. Этот вектор используется для проникновения в клетку человеческого тела». Cell . 37 (3): 1053–1062. DOI : 10.1016 / 0092-8674 (84) 90440-9 . PMID 6331674 . S2CID 34544709 .
- ^ «Первая генная терапия» . Фонд наук о жизни. 21 июня 2011 года Архивировано из оригинала 28 ноября 2012 года . Проверено 7 января 2014 года .
- ^ Blaese RM, Culver KW, Miller AD, Carter CS, Fleisher T, Clerici M и др. (Октябрь 1995 г.). «Т-лимфоцит-направленная генная терапия ADA-SCID: первые результаты испытаний через 4 года» . Наука . 270 (5235): 475–480. Bibcode : 1995Sci ... 270..475B . DOI : 10.1126 / science.270.5235.475 . PMID 7570001 . S2CID 46339645 .
- Перейти ↑ Trojan J, Johnson TR, Rudin SD, Ilan J, Tykocinski ML, Ilan J (январь 1993). «Лечение и профилактика глиобластомы крысы с помощью иммуногенных клеток C6, экспрессирующих антисмысловую РНК инсулиноподобного фактора роста I.». Наука . 259 (5091): 94–97. Bibcode : 1993Sci ... 259 ... 94T . DOI : 10.1126 / science.8418502 . PMID 8418502 .
- ^ a b Троян J, Pan YX, Wei MX, Ly A, Shevelev A, Bierwagen M и др. (2012). "Методика антигенной терапии злокачественных опухолей анти-IGF-I" . Исследования и практика химиотерапии . 2012 : 1–12. DOI : 10.1155 / 2012/721873 . PMC 3287029 . PMID 22400112 .
- ↑ Abbott A (апрель 1992 г.). «Генная терапия. Итальянцы первыми использовали стволовые клетки». Природа . 356 (6369): 465. Bibcode : 1992Natur.356..465A . DOI : 10.1038 / 356465a0 . PMID 1560817 . S2CID 4319842 .
- ^ Cavazzana-Кальво M, Thrasher A, Mavilio F (февраль 2004). «Будущее генной терапии». Природа . 427 (6977): 779–781. Bibcode : 2004Natur.427..779C . DOI : 10.1038 / 427779a . PMID 14985734 . S2CID 4421364 .
- ^ S; Блейксли, Ра (18 мая 1993 г.). «Лечение« Болезни мальчика-пузыря » » . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 9 февраля 2018 .
- ↑ Stein R (11 октября 2010 г.). «Первый пациент, прошедший курс лечения стволовыми клетками» . Вашингтон Пост . Проверено 10 ноября 2010 года .
- ^ «Смерть побуждает FDA приостановить испытания генной терапии артрита» . Medpage сегодня. 27 июля 2007 . Проверено 10 ноября 2010 года .
- ↑ Стольберг С.Г. (22 января 2000 г.). «В университете прекращена генная терапия» . Нью-Йорк Таймс . Проверено 10 ноября 2010 года .
- ^ Wilson JF (18 марта 2002). «Мышиная генная терапия корректирует симптомы серповидноклеточной болезни» . Ученый - журнал наук о жизни . Проверено 17 августа 2010 года .
- ^ St. Jude Детский исследовательский госпиталь (4 декабря 2008). «Генная терапия исправляет серповидноклеточную болезнь в лабораторных исследованиях» . ScienceDaily . Проверено 29 декабря 2012 года .
- ^ Penman D (11 октября 2002). «Тонкая генная терапия борется с заболеванием крови» . Новый ученый . Проверено 17 августа 2010 года .
- ^ "ДНК-наношарики ускоряют генную терапию" . Новый ученый . 12 мая 2002 . Проверено 17 августа 2010 года .
- ^ Ananthaswamy A (20 марта 2003). «Гены под прикрытием проникают в мозг» . Новый ученый . Проверено 17 августа 2010 года .
- ↑ Holmes B (13 марта 2003 г.). «Генная терапия может выключить болезнь Хантингтона» . Новый ученый . Проверено 17 августа 2010 года .
- ^ Ott MG, Schmidt M, Schwarzwaelder K, Stein S, Siler U, Koehl U, et al. (Апрель 2006 г.). «Коррекция Х-связанной хронической гранулематозной болезни с помощью генной терапии, усиленная инсерционной активацией MDS1-EVI1, PRDM16 или SETBP1» . Природная медицина . 12 (4): 401–409. DOI : 10.1038 / nm1393 . PMID 16582916 . S2CID 7601162 .
- ^ Коричневый BD, Venneri MA, Zingale A, Sergi Sergi L, L Naldini (май 2006). «Регуляция эндогенной микроРНК подавляет экспрессию трансгена в гемопоэтических клонах и обеспечивает стабильный перенос генов». Природная медицина . 12 (5): 585–591. DOI : 10.1038 / nm1398 . PMID 16633348 . S2CID 11114427 .
- ^ Морган Р.А., Дадли М.Э., Вундерлих-младший, Хьюз М.С., Ян Дж. К., Шерри Р.М. и др. (Октябрь 2006 г.). «Регресс рака у пациентов после переноса генно-инженерных лимфоцитов» . Наука . 314 (5796): 126–129. Bibcode : 2006Sci ... 314..126M . DOI : 10.1126 / science.1129003 . PMC 2267026 . PMID 16946036 .
- ^ Левин Б.Л., Юмо Л.М., Бойер Дж., МакГрегор Р.Р., Ребелло Т., Лу Х и др. (Ноябрь 2006 г.). «Перенос генов у людей с использованием лентивирусного вектора с условной репликацией» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (46): 17372–17377. Bibcode : 2006PNAS..10317372L . DOI : 10.1073 / pnas.0608138103 . PMC 1635018 . PMID 17090675 .
- ^ «Penn Medicine представляет данные испытаний генной терапии ВИЧ на CROI 2009» . EurekAlert! . 10 февраля 2009 . Проверено 19 ноября 2009 года .
- ^ «Генная терапия сначала для плохого зрения» . BBC News . 1 мая 2007 . Проверено 3 мая 2010 года .
- ^ Долгин E (2009). «Дальтонизм исправляется генной терапией». Природа . DOI : 10.1038 / новости.2009.921 .
- ^ Картье Н., Хасейн-Бей-Абина С., Бартолома СС, Верес Г., Шмидт М., Кутчера И. и др. (Ноябрь 2009 г.). «Генная терапия гемопоэтическими стволовыми клетками с лентивирусным вектором при Х-связанной адренолейкодистрофии». Наука . 326 (5954): 818–823. Bibcode : 2009Sci ... 326..818C . DOI : 10.1126 / science.1171242 . PMID 19892975 . С2КИД 27783 .
- ^ Komáromy AM, Александр JJ, Rowlan JS, Garcia М.М., Chiodo В.А., Kaya А, и др. (Июль 2010 г.). «Генная терапия спасает функцию колбочек при врожденной ахроматопсии» . Молекулярная генетика человека . 19 (13): 2581–2593. DOI : 10,1093 / HMG / ddq136 . PMC 2883338 . PMID 20378608 .
- ^ Cavazzana-Calvo M, Payen E, Negre O, Wang G, Hehir K, Fusil F и др. (Сентябрь 2010 г.). «Независимость от переливания и активация HMGA2 после генной терапии β-талассемии человека» . Природа . 467 (7313): 318–322. Bibcode : 2010Natur.467..318C . DOI : 10,1038 / природа09328 . PMC 3355472 . PMID 20844535 .
- ^ Galanello R, R Origa (май 2010). «Бета-талассемия» . Журнал "Орфанет редких болезней" . 5 : 11. DOI : 10,1186 / 1750-1172-5-11 . PMC 2893117 . PMID 20492708 .
- ^ a b Билс, Жаклин К. (16 сентября 2010 г.). Генная терапия избавляет пациентов с бета-талассемией от переливаний на 2+ года . Medscape.com (16 сентября 2010 г.). Проверено 15 декабря 2012 года.
- ^ Б Leboulch P (20 марта 2013). «Пятилетние результаты лентивирусной генной терапии бета-талассемии человека, уроки и перспективы» . Отчеты о талассемии . 3 (1 с): 108. doi : 10.4081 / thal.2013.s1.e43 .
- ^ a b Номер клинического испытания NCT01639690 для « Большая β-талассемия с аутологичными CD34 + гемопоэтическими клетками-предшественниками, трансдуцированными лентивирусным вектором TNS9.3.55, кодирующим нормальный ген β-глобина человека» на ClinicalTrials.gov
- ^ Троян A, Аристизабал BH, Джей Л.М., Кастильо Т, Пенагос П.Дж., Брисеньо I, Троян J (2016). «Тестирование биомаркера IGF-I в этическом контексте» . Adv Modern Oncol Res . 2 (4): 188–200. DOI : 10,18282 / amor.v2.i4.58 .
- Перейти ↑ Castillo T, Trojan A, Noguera MC, Jay LM, Crane C, Alvarez A, Kasprzak H, Melo G, Penagos PJ, Shevelev A, Aristizabal BH, Briceño I, Ayala A, Duc HT, Trojan J (2016). "Эпистемологический опыт разработки технологии биомолекулярной параэстратгии генетической иммунотерапии" [Эпистемологический опыт разработки технологии молекулярной биологии для стратегии иммуногенной терапии]. Rev Cien (на испанском языке). 2 (25): 228–240. DOI : 10.14483 // udistrital.jour.RC.2016.25.a6 .
- ↑ Розенберг, Тина (29 мая 2011 г.) «Человек, у которого был ВИЧ, но теперь его нет» , Нью-Йорк .
- ^ "Генная терапия избавляет от рака нескольких больных лейкемией. Будет ли она работать и для других видов рака?" . Singularity Hub. 6 января 2014 . Проверено 7 января 2014 года .
- ^ Ян ZJ, Zhang YR, Chen B, Zhang SL, Jia EZ, Wang LS и др. (Июль 2009 г.). «Фаза I клинических испытаний интракоронарного введения Ad-hHGF при лечении тяжелой ишемической болезни сердца». Отчеты по молекулярной биологии . 36 (6): 1323–1329. DOI : 10.1007 / s11033-008-9315-3 . PMID 18649012 . S2CID 23419866 .
- ^ Хан В., Пюн В.Б., Ким Д.С., Ю В.С., Ли С.Д., Вон Дж. Х. и др. (Октябрь 2011 г.). «Усиленные кардиозащитные эффекты за счет совместной экспрессии двух изоформ фактора роста гепатоцитов из обнаженной плазмидной ДНК в модели ишемической болезни сердца у крыс». Журнал генной медицины . 13 (10): 549–555. DOI : 10.1002 / jgm.1603 . PMID 21898720 . S2CID 26812780 .
- ^ AdisInsight Генная терапия фактора роста эндотелия сосудов - Страница HSCI, доступ 5 июня 2016 г.
- ^ Eurolab. Список неоваскулогенов на странице Eurolab, по состоянию на 4 августа 2015 г.
- ^ Деев Р.В., Бозо И.Ю., Мжаванадзе Н.Д., Воронов Д.А., Гавриленко А.В., Червяков Ю.В. и др. (Сентябрь 2015 г.). «Внутримышечный перенос гена pCMV-vegf165 - эффективный метод лечения пациентов с хронической ишемией нижних конечностей». Журнал сердечно-сосудистой фармакологии и терапии . 20 (5): 473–482. DOI : 10.1177 / 1074248415574336 . PMID 25770117 . S2CID 13443907 .
- ^ «О раке: начало испытаний терапии стволовыми клетками дает надежду пациентам с наследственным заболеванием крови» . Мемориальный онкологический центр Слоуна-Кеттеринга. 16 июля 2012 . Проверено 15 декабря 2012 года .
- ^ Поллак, Эндрю (20 июля 2012 г.) Европейское агентство поддерживает одобрение генной терапии , The New York Times .
- ^ Первая генная терапия, одобренная Европейской комиссией. Архивировано 5 ноября 2012 года в Wayback Machine . UniQure (2 ноября 2012 г.). Проверено 15 декабря 2012 года.
- ^ «Chiesi и uniQure задерживают запуск Glybera для добавления данных» . Биотехнология . Фармацевтическое письмо . 4 августа 2014 . Проверено 28 августа 2014 .
- ↑ Burger L, Hirschler B (26 ноября 2014 г.). «Первый препарат для генной терапии устанавливает рекорд по цене в миллион евро» . Рейтер . Проверено 30 марта 2015 года .
- ↑ Whalen J (2 ноября 2012 г.). «Одобрение генной терапии является важной вехой» . Wall Street Journal .
- ↑ Morrison C (3 марта 2015 г.). «Цена в 1 миллион долларов за генную терапию Glybera». TradeSecrets .
- ^ Генная терапия впервые одобрена в Европе
- ^ Regalado A (4 мая 2016). «Самое дорогое лекарство в мире обанкротилось» . Обзор технологий Массачусетского технологического института .
- ^ Bosely, Сара (30 апреля 2013). «Новаторские испытания генной терапии вселяют надежду для сердечных больных» . Хранитель . Проверено 28 апреля 2014 года .
- ^ Первое испытание генной терапии сердечной недостаточности начинается в Великобритании . Клиника врачей (8 сентября 2013 г.). Архивировано 29 апреля 2014 г. в Wayback Machine.
- ^ Celladon получает от FDA обозначение в качестве прорывной терапии для MYDICAR (R), новой, первой в своем классе терапии в разработке для лечения сердечной недостаточности. Архивировано 10 июля 2015 года в Wayback Machine . New York Times (10 апреля 2014 г.)
- ^ Фернандес-Руис I (март 2016 г.). «Генная терапия: нет улучшения результатов с помощью генной терапии сердечной недостаточности». Обзоры природы. Кардиология . 13 (3): 122–123. DOI : 10.1038 / nrcardio.2016.14 . PMID 26843287 . S2CID 205472001 .
- ^ Biffi A, Montini E, Lorioli L, Cesani M, Fumagalli F, Plati T и др. (Август 2013). «Лентивирусная генная терапия гемопоэтическими стволовыми клетками приносит пользу при метахроматической лейкодистрофии» . Наука . 341 (6148): 1233158. DOI : 10.1126 / science.1233158 . PMID 23845948 . S2CID 206546808 .
- ^ Aiuti A, Biasco L, Scaramuzza S, Ferrua F, Cicalese MP, Baricordi C и др. (Август 2013). «Лентивирусная генная терапия гемопоэтическими стволовыми клетками у пациентов с синдромом Вискотта-Олдрича» . Наука . 341 (6148): 1233151. DOI : 10.1126 / science.1233151 . PMC 4375961 . PMID 23845947 .
- ↑ Gallagher, James (21 апреля 2015 г.) Генная терапия: «Приручить ВИЧ» для лечения болезней BBC News, Health, последнее обращение 21 апреля 2015 г.
- ^ Malech HL, Окс HD (апрель 2015). «Наступающая эра клинической пользы от генной терапии». ДЖАМА . 313 (15): 1522–1523. DOI : 10,1001 / jama.2015.2055 . PMID 25898049 .
- ↑ Генная терапия для лечения детей с болезнью пузыря . Science Daily (18 ноября 2014 г.)
- ^ Генная терапия обеспечивает безопасное, долгосрочное облегчение для пациентов с тяжелой формой гемофилии . Science Daily (20 ноября 2014 г.)
- ^ Beali, Abigail (25 января 2014) Генная терапия восстанавливает зрение у людей с болезнью глаз The New Scientist. Проверено 25 января 2014 г.
- ^ Тебас П., Штейн Д., Тан В.В., Фрэнк I, Ван SQ, Ли Джи и др. (Март 2014 г.). «Редактирование генов CCR5 в аутологичных CD4 Т-клетках людей, инфицированных ВИЧ» . Медицинский журнал Новой Англии . 370 (10): 901–910. DOI : 10.1056 / NEJMoa1300662 . PMC 4084652 . PMID 24597865 .
- ^ Дворский, Джордж (6 марта 2014 г.) Ученые создают генетически модифицированные клетки, защищающие от ВИЧ io9, Биотехнология. Проверено 6 марта 2014 г.
- ^ Номер клинического испытания NCT02247843 "Генная терапия стволовыми клетками для серповидноклеточной болезни" на ClinicalTrials.gov
- ^ Номер клинического испытания NCT00012545 "Сбор и хранение стволовых клеток пуповины для лечения серповидноклеточной болезни" на ClinicalTrials.gov
- ^ «Десять вещей, которые вы могли пропустить в понедельник из мира бизнеса» . Бостон Глоуб . 3 февраля 2015 . Проверено 13 февраля 2015 года .
- ↑ Zimmer C (9 марта 2015 г.). «Защита без вакцины» . Нью-Йорк Таймс . Проверено 30 марта 2015 года .
- ^ Gardner MR, Kattenhorn LM, Kondur HR, von Schaewen M, Dorfman T, Chiang JJ, et al. (Март 2015 г.). «AAV-экспрессируемый eCD4-Ig обеспечивает надежную защиту от множественных заражений SHIV» . Природа . 519 (7541): 87–91. Bibcode : 2015Natur.519 ... 87G . DOI : 10,1038 / природа14264 . PMC 4352131 . PMID 25707797 .
- ↑ Генри Р. (19 февраля 2017 г.). «Надежды на излечение лейкемии возрастают по мере того, как девочка подвергается генетическому редактированию» . The Times . Проверено 20 февраля 2017 года .
- ^ Образец I (5 ноября 2015 г.). «Девочку впервые в мире начали лечить« дизайнерскими иммунными клетками » » . Хранитель . Проверено 6 ноября 2015 года .
- ↑ Wade N (3 декабря 2015 г.). «Ученые вводят мораторий на правки в геноме человека, которые могут быть унаследованы» . Нью-Йорк Таймс . Дата обращения 3 декабря 2015 .
- ↑ Walsh F (3 декабря 2015 г.). «Генное редактирование: приближается ли эра дизайнерских людей?» . BBC News Health . Проверено 31 декабря 2015 года .
- ↑ Генетически измененная кожа спасает мальчика от редкой болезни
- ^ "Краткое изложение мнения1 (первоначальное разрешение) Стримвелис" (PDF) . Европейское агентство по лекарственным средствам . 1 апреля 2016. С. 1–2 . Проверено 13 апреля +2016 .
- ^ Hirscheler B (1 апреля 2016). «Европа дает зеленый свет первой генной терапии для детей» . Рейтер . Проверено 13 апреля +2016 .
- ↑ Reeves R (6 июня 2016 г.). «Вторая генная терапия получает одобрение в Европе» . Бионьюс . Проверено 20 февраля 2017 года .
- ^ Колен А (9 апреля 2016). «Одобрено генной терапией» . Новый Ученый . № 3068. С. 8–9.
- ^ Cyranoski D (июль 2016). «Китайские ученые первопроходцы первого испытания CRISPR на людях» . Природа . 535 (7613): 476–477. Bibcode : 2016Natur.535..476C . DOI : 10.1038 / nature.2016.20302 . PMID 27466105 .
- ↑ Bennett J (15 ноября 2016 г.). «Китайские ученые первыми применили генное редактирование CRISPR на людях» . Популярная механика . Проверено 16 ноября +2016 .
- ↑ Lee TW, Southern KW, Perry LA, Penny-Dimri JC, Aslam AA (июнь 2016 г.). Южный KW (ред.). «Местная замена гена регулятора трансмембранной проводимости муковисцидоза для заболевания легких, связанного с муковисцидозом». Кокрановская база данных систематических обзоров (6): CD005599. DOI : 10.1002 / 14651858.CD005599.pub5 . PMID 27314455 .
- ↑ Whipple T (1 марта 2017 г.). «Новая генная терапия„усадку опухоли , такие как кубики льда “ » . The Times . Проверено 1 марта 2017 года .
- ^ Колен A (март 2017). «Генная терапия« излечивает »мальчика от болезни крови, от которой страдают миллионы» . Новый ученый .
- ^ «Утверждение FDA приносит первую генную терапию в Соединенных Штатах» . Выпуск новостей FDA . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 30 августа 2017.
- ^ Исследования, Центр оценки лекарственных средств и. «FDA одобрило использование аксикабтагена цилолейцела для лечения В-клеточной лимфомы большого размера» . www.fda.gov . Проверено 5 января 2018 года .
- ^ Zayner, Иосия (6 октября 2017). "DIY Human CRISPR Myostatin Knock-Out" . Youtube . Проверено 20 мая 2020 .
- ^ Зайнер, Джозайя. «Первая попытка редактирования гена CRISPR человека» . Проверено 20 мая 2020 .
- ^ «AP Exclusive: американские ученые пробуют редактировать первый ген в организме» . AP NEWS . Дата обращения 17 ноября 2020 .
- ^ KaiserNov. 15, Джоселин; 2017; Вечер, 18:00 (15 ноября 2017 г.). «Человеку ввели инструменты для редактирования генов, чтобы вылечить его недееспособное заболевание. Вот что вам нужно знать» . Наука | AAAS . Дата обращения 17 ноября 2020 .CS1 maint: числовые имена: список авторов ( ссылка )
- ↑ Чжан, Сара (15 ноября 2017 г.). «Первый человек, чьи гены отредактированы внутри своего тела» . Атлантика . Дата обращения 17 ноября 2020 .
- ^ Ледфорд Хейди (5 сентября 2018). «Первый тест на редактирование генов в теле обнадеживает» . Природа . DOI : 10.1038 / d41586-018-06195-6 .
- ↑ Маркионе, Мэрилин (7 февраля 2019 г.). «Испытания предполагают ученые достигли 1 - го„в теле“редактирования генов» . AP News . Проверено 7 февраля 2019 .
- ^ Персонал (2 февраля 2019 г.). «Изучение возрастающей дозы редактирования генома с помощью нуклеазы цинкового пальца (ZFN), терапевтической SB-913 у субъектов с MPS II» . ClinicalTrials.gov . Национальная медицинская библиотека США . Проверено 7 февраля 2019 .
- ^ Рангараджан С., Уолш Л., Лестер В., Перри Д., Мадан Б., Лаффан М. и др. (Декабрь 2017 г.). «Перенос гена фактора VIII AAV5 при тяжелой гемофилии А» . Медицинский журнал Новой Англии . 377 (26): 2519–2530. DOI : 10.1056 / nejmoa1708483 . ЛВП : 10044/1/57163 . PMID 29224506 .
- ↑ van den Berg HM (декабрь 2017 г.). «Лекарство от гемофилии в пределах досягаемости». Медицинский журнал Новой Англии . 377 (26): 2592–2593. DOI : 10.1056 / nejme1713888 . PMID 29224412 .
- ↑ Офис Уполномоченного (19 декабря 2017 г.). «FDA одобряет новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения» . FDA . Проверено 20 декабря 2017 года .
- ^ Herper, Мэтью (3 января 2018). «Spark Therapeutics устанавливает цену на генную терапию для лечения слепоты в 850 000 долларов» . Forbes . Проверено 4 января 2018 .
- ↑ Sheridan K (19 декабря 2017 г.). «FDA одобрило генную терапию для лечения слепоты в революционный момент для медицины, основанной на ДНК» . Newsweek . Проверено 20 декабря 2017 года .
- ↑ Стейн, Роб (24 мая 2019 г.). «При цене 2,1 миллиона долларов новая генная терапия является самым дорогим лекарством на свете» . NPR . Проверено 24 мая 2019 .
- ↑ Тонг, Янтарь (3 июня 2019 г.). «ЕС традиционно одобряет генную терапию bluebird для лечения β-талассемии - теперь расслабьтесь и дождитесь цены» . Дата обращения 4 июня 2019 .
- ^ "Zynteglo EPAR" . Европейское агентство по лекарственным средствам (EMA) . Проверено 8 июня 2020 .Текст был скопирован из этого источника © Европейское агентство по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Исследование однократной возрастающей дозы у участников с LCA10» . Clinicaltrials.gov . Проверено 20 августа 2019 .
- ^ «Allergan и Editas Medicine инициируют клиническое испытание фазы 1/2 Brilliance AGN-151587 (EDIT-101) для лечения LCA10» . Editas Medicine . Проверено 20 августа 2019 .
- ^ Ледфорд Хейди (5 марта 2020). «Впервые процедура CRISPR вводится прямо в тело» . Природа . 579 (7798): 185. Bibcode : 2020Natur.579..185L . DOI : 10.1038 / d41586-020-00655-8 . PMID 32157225 .
- ^ "Золгенсма EPAR" . Европейское агентство по лекарственным средствам (EMA) . Проверено 16 октября 2020 года .
- ^ «Audentes Therapeutics предоставляет обновленную информацию о клинических испытаниях ASPIRO по оценке AT132 у пациентов с Х-сцепленной миотубулярной миопатией» . Audentes Therapeutics . 10 августа 2020 . Проверено 21 сентября 2020 года .
- ^ "Audentes Астеллы сообщает о третьей смерти в испытании генной терапии" . FierceBiotech . Проверено 21 сентября 2020 года .
- ^ "Смерти при генной терапии высоких доз AAV" . Природа Биотехнологии . 38 (8): 910. 1 августа 2020 г. doi : 10.1038 / s41587-020-0642-9 . ISSN 1546-1696 . PMID 32760031 . S2CID 220981004 .
- ^ a b «Либмельды: ожидает решения ЕС» . Европейское агентство по лекарственным средствам (EMA) . 16 октября 2020 . Проверено 16 октября 2020 года .Текст был скопирован из этого источника © Европейское агентство по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Новая генная терапия для лечения метахроматической лейкодистрофии редких генетических заболеваний» . Европейское агентство по лекарственным средствам . 16 октября 2020 . Проверено 16 октября 2020 года .Текст был скопирован из этого источника © Европейское агентство по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ "Либмелды EPAR" . Европейское агентство по лекарственным средствам (EMA) . 13 октября 2020 . Проверено 22 декабря 2020 .
- ^ Лизоген. «Lysogen представляет обновленную информацию о клиническом испытании AAVance по оценке LYS-SAF302 у пациентов с MPS IIIA - лизоген» . Проверено 17 октября 2020 года .
- ^ "Я - легенда из реальной жизни?" Исследователь поддерживает разработку «реовируса» как потенциального лечения рака » . Sciencedaily.com. 9 мая 2008 . Проверено 17 августа 2010 года .
- ^ Будет ли генная терапия изменить человеческую расу? в IMDb
- ↑ Cass S (15 сентября 2008 г.). "Звездные врата Атлантиды: генная терапия" . Откройте для себя . Проверено 14 декабря +2016 .
- ^ Билер, Стэн; Диксон, Лиза (11 июля 2006 г.). Чтение Звездных врат SG-1 . IBTauris. ISBN 978-1-84511-183-0.
Дальнейшее чтение [ править ]
- Тиньков С., Бекереджян Р., Винтер Дж., Кустер С. (20 ноября 2000 г.). «Микропузырьки, конъюгированные с полиплексом, для усиленной направленной ультразвуковой генной терапии» (PDF) . Всемирный конгресс-центр Джорджии , Атланта, Джорджия: Ежегодное собрание и выставка AAPS в 2008 году. Архивировано из оригинального (PDF) 7 июля 2012 года . Проверено 26 января 2009 года .
- Гардлик Р., Палфи Р., Ходози Дж., Лукач Дж., Турна Дж., Селец П. (апрель 2005 г.). «Векторы и системы доставки в генной терапии». Монитор медицинской науки . 11 (4): RA110–121. PMID 15795707 .
- Персонал (18 ноября 2005 г.). «Генная терапия» (FAQ) . Информация о проекте "Геном человека" . Национальная лаборатория Окриджа . Проверено 28 мая 2006 года .
- Salmons B, Günzburg WH (апрель 1993 г.). «Нацеливание ретровирусных векторов для генной терапии». Генная терапия человека . 4 (2): 129–141. DOI : 10.1089 / hum.1993.4.2-129 . PMID 8494923 .
- Баум К., Дюльманн Дж., Ли З., Фезе Б., Мейер Дж., Уильямс Д.А., фон Калле С. (март 2003 г.). «Побочные эффекты переноса ретровирусного гена в гемопоэтические стволовые клетки». Кровь . 101 (6): 2099–2114. DOI : 10,1182 / кровь 2002-07-2314 . PMID 12511419 .
- Хорн П.А., Моррис Дж. К., Нефф Т., Кием ХП (сентябрь 2004 г.). «Перенос генов стволовых клеток - эффективность и безопасность в исследованиях на крупных животных» . Молекулярная терапия . 10 (3): 417–431. DOI : 10.1016 / j.ymthe.2004.05.017 . PMID 15336643 .
- Ван Х., Шаяхметов Д.М., Лиге Т., Харки М., Ли К., Папаяннопулу Т., Стаматояннополус Г., Либер А. (сентябрь 2005 г.). «Хелпер-зависимый аденовирусный вектор с модифицированным капсидом, содержащий контрольную область бета-глобинового локуса, демонстрирует неслучайный паттерн интеграции и обеспечивает стабильную, специфичную для эритроида экспрессию гена» . Журнал вирусологии . 79 (17): 10999–11013. DOI : 10,1128 / JVI.79.17.10999-11013.2005 . PMC 1193620 . PMID 16103151 .
Внешние ссылки [ править ]
| В Викиучебнике есть книга на тему: « Гены, технологии и политика». |
| Викискладе есть медиафайлы по теме генной терапии . |
- Производство коммерческих генных терапий к 2020 г.